
【题目】化合物 A 含有碳、氢、氧三种元素,其质量比是 3:1:4,B 是最简单的芳香烃,D 是有芳香气味的酯。它们之间的转换关系如下:

回答下列问题:
(1)A 的结构简式为__________________________________________。
(2)C 中的官能团为__________________________________________。
(3) ![]() 的一氯代物有_________________________________________种。(不考虑立体异构)
的一氯代物有_________________________________________种。(不考虑立体异构)
(4)反应④的化学方程式为______________________________________________________________。
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Cl2通入水中:Cl2 + H2O = 2H+ + Cl- + ClO-
B.FeCl3溶液腐蚀铜箔制印刷线路板:Fe3+ + Cu = Fe2+ + Cu2+
C.H2SO4溶液和Ba(OH)2溶液混合:H+ + SO42- + Ba2+ + OH-= BaSO4↓ + H2O
D.澄清石灰水中通入过量二氧化碳:OH- + CO2 = HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,![]() 的溶液一定是酸溶液
的溶液一定是酸溶液
B.常温下,![]() 的醋酸溶液和
的醋酸溶液和![]() 的氢氧化钠溶液等体积混合后,溶液呈碱性
的氢氧化钠溶液等体积混合后,溶液呈碱性
C.在相同温度下,物质的量浓度相等的氢氧化钠、氨水溶液,![]()
D.向醋酸钠溶液中滴加醋酸至![]() ,则溶液呈中性
,则溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示。

(1)若A为强碱,C、D常被用做食用“碱”。C → D反应的离子方程式为 ______________。
(2)若A为使用最广泛的金属单质,B是某强酸的稀溶液,则检验D溶液中金属阳离子的试剂为_____________,D → C反应的离子方程式为___________。
(3)若A为非金属单质,D是空气中的主要温室气体。D还可以转化为A,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z 是位于不同主族的五种短周期元素,其原子序数依次增大。
①W 的氢化物与 W 最高价氧化物对应水化物反应生成化合物甲。
②X、Y、Z 的最高价氧化物对应水化物之间两两反应均可生成盐和水。
③常温下,Q 的最高价气态氧化物与化合物 X2O2 发生反应生成盐乙。
请回答下列各题:
(1)甲的水溶液呈酸性,用离子方程式表示其原因____________________________________________________________________________。
(2)③中反应的化学方程式为________________________________________________________________________________________________。
(3)已知:ZO3n-+M2++H+→Z-+M4+ + H2O(M 为金属元素,方程式未配平)由上述信息可推测 Z 在周期表中位置为________________________________________________________________________________________________。
(4)Y 形成的难溶半导体材料 CuYO2 可溶于稀硝酸,同时生成 NO。写出此反应的离子方秳式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A.2n mol B,发生反应:A(g)+2B(g) ![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=________。在保证A浓度不变的情况下,扩大容器的体积,平衡______(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1.t3.t7时都达到了平衡,而t2.t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时_________________________。
②t2时平衡向___________________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列有关胆矾的说法不正确的是
A.胆矾中有轨道杂化的氧原子和硫原子杂化方式为sp3
B.胆矾中含有的作用力有离子键、极性共价键、配位键、氢键
C.Cu2+价电子排布式为3d84s1
D.胆矾的结晶水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态F原子的价层电子的轨道表达式为____。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为_____,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_____和_____(各举一例)。
(3)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。![]() 中中心原子的杂化类型是_____;氟化铵中存在的化学键是_____(填字母)。
中中心原子的杂化类型是_____;氟化铵中存在的化学键是_____(填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为____kJ·mol-1,S-F键的键能为____kJ·mol-1。
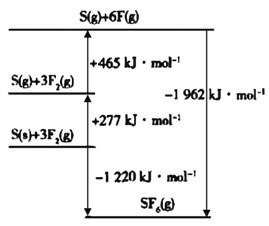
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com