
����Ŀ�����淴Ӧ��2NO2![]() 2NO+O2���̶�����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־���� ��
2NO+O2���̶�����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־���� ��
�ٵ�λʱ��������n molO2��ͬʱ����2n molNO2
�ڵ�λʱ��������n molO2 ��ͬʱ������2n mol NO
����NO2��NO��O2 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2 : 2 : 1��״̬
�ܻ���������ɫ���ٸı��״̬
�ݻ��������ܶȲ��ٸı��״̬
��������ƽ����Է����������ٸı��״̬
A.�٢ܢ� B.�ڢۢ� C.�٢ۢ� D.�٢ڢۢܢݢ�
���𰸡�A
��������
�����������һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬����ɫ��dz��Ũ���й�ϵ����������ȷ�����з�Ӧ���ʵķ����෴������������֮������Ӧ�Ļ�ѧ������֮�ȣ���ȷ�����з�Ӧ���ʵķ�������ͬ�ģ�����ȷ������֮������Ӧ�Ļ�ѧ������֮�ȣ�������еĹ�ϵʼ���dz���������ȷ���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ�������ȷ���������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ���������䣬�����ʵ����DZ仯�ģ�����������˵������ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���δ�������ҽѧ���δȵġ�ϴԩ��¼������һ�����鶾�ļ��أ��������鶾����ԭ����4Ag + 2H2S + O2 =" 2X" + 2H2O������˵����ȷ����
A. X�Ļ�ѧʽΪAgS B. �����鶾ʱ������������ʧȥ����
C. ��Ӧ��Ag��H2S���ǻ�ԭ�� D. ÿ����1mo1X����Ӧת��2mo1e-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��3�����ʽṹ�����ʡ�
��������ͭ�����ճ������г����Ľ��������ǵĵ��ʼ��仯�����ڿ�ѧ�о���ũҵ�����о��й㷺��;����ش��������⣺
��1����ϸͭ�ۿ�����������ϡ������ȣ����Ʊ��������£�
![]()
��ͭԪ��λ�����ڱ�_________����Cu+�Ļ�̬�۵����Ų�ͼ_________��NH4CuSO3��N��S��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_________��Ԫ�ط��ű�ʾ����
��SO42-����ԭ�ӵ��ӻ���ʽΪ_________��SO32-�ļ۲���ӻ���ģ��Ϊ_________��
��2����д����Cu(NH3)4SO4ˮ��Һ��ͨ��SO2ʱ������Ӧ�����ӷ���ʽ_________��
��3��ijѧ����CuSO4��Һ�м���������ˮ������ɫ�������������������ˮ�����ܽ⣬�õ�����ɫ����Һ����������Һ�м���һ�����Ҵ�������[Cu(NH3)4]SO4��H2O���塣
������˵����ȷ����_________��
a����NH3��H2O��Ϊ���Է��ӣ������ǻ����ڷ������������������������ˮ
b��NH3���Ӻ�H2O���ӣ����ӿռ乹�Ͳ�ͬ���������ӵļ���С��ˮ���ӵļ���
c��Cu(NH3)4SO4�����еĻ�ѧ�������Ӽ������Թ��ۼ�����λ��
d��Cu(NH3)4SO4���Ԫ���е縺�������ǵ�Ԫ��
������ͼ����Ҵ������������ԭ��_________��
��4����ͼ��ʾΪ����ͭ��һ���������˾���������ı߳�Ϊa pm��Cu�����ԭ������Ϊ64������ͭ���ܶ�Ϊ�� g/cm3������ͭԭ�ӵ���λ��Ϊ_________���ú���a�����Ĵ���ʽ��ʾ�İ����ӵ�����Ϊ��_________ mol-1��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ﵽ����ʵ��Ŀ�ģ������õķ������������� ��
A����ˮ����ȡ�壺��Һ
B������ˮ�����͵Ļ�������
C�����뱥��ʳ��ˮ��ɳ�ӵĻ�������
D��������غ��Ȼ��ƻ��Һ�л�ȡ����أ���ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йط���ʽ��д��ȷ������ ��
A��������Һ������������Һ��Ӧ�����ӷ���ʽΪH����OH����H2O
B��H2S��ˮ��Һ�еĵ��룺H2S+H2O![]() H3O++ HS��
H3O++ HS��
C�������ȼ����Ϊ890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
CH4 (g)��2O2 (g) == CO2 (g)��2H2O (g) ��H����890.3 kJ��mol��1
D��˫��ˮ�м���ϡ�����KI��Һ: H2O2+ 2I-+H+![]() I2+ 2H2O
I2+ 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��鷴Ӧ�й��������ıȽ���ȷ���ǣ�������
��H2��g��+Cl2��g��=2HCl��g����H1�� ![]() H2��g��+
H2��g��+![]() Cl2��g��=HCl ��g����H2����H1����H2
Cl2��g��=HCl ��g����H2����H1����H2
��2H2O��l��=2H2��g��+O2��g����H1�� 2Na��s��+2H2O��l��=2NaOH��aq��+H2��g����H2����H1����H2
��CH3OH��g��+![]() O2��g��=CO2��g��+2H2O��l����H1��CH3OH��l��+
O2��g��=CO2��g��+2H2O��l����H1��CH3OH��l��+![]() O2��g��=CO2��g��+2H2O��g����H2����H1����H2
O2��g��=CO2��g��+2H2O��g����H2����H1����H2
��t��ʱ����һ�������£��� 1mol N2�� 3mol H2 �ֱ����ں��ݺͺ�ѹ�������ܱ������У��ﵽƽ��״̬ʱ�ų��������ֱ�Ϊ Q1��Q2�� Q1��Q2��
A. �٢ۢ� B. �٢ڢ� C. �ڢۢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ç������һ�ֺϳ�����������ҩ���Ƶ�ԭ�ϣ����������ƻ������ʯ���ֲ���У����й����������л��������˵����ȷ����
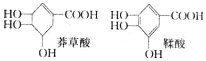
A�������ʵ������������ʸ�������NaOH��Ӧ������NaOH�������
B����ȫȼ�յ����ʵ����������������ɶ�����̼��ˮ�����ֱ����
C��һ�������£��������ʶ��ܷ���������Ӧ��������Ӧ
D����������У�������ͬһƽ���ϵ�ԭ�������14��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڴ������������ʡ��ǵ���ʵ���ȷ���Ϊ��������
������ | ����� | ����� | �ǵ���� | |
A | ���� | ��ˮ����� | ���� | �ɱ� |
B | ����ˮ | ������Һ | �Ȼ�ͭ | �������� |
C | ���� | ���� | �� | ̼��� |
D | ���� | ʳ��ˮ | ������ | ̼���� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ��ж����ڵ�һ���֣�����YԪ�ص�ԭ������ΪM��NԪ��ԭ������֮�͡�����˵����ȷ����( )
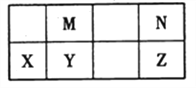
A. �⻯����ȶ��ԣ�N >Z������Ϊ���⻯����ӿ��γ����
B. Ԫ�صķǽ����ԣ�M > Y������Ϊ����M����YN2��Ӧ���ɵ���Y
C. �۷е㣺YN2>MN2������ΪYN2�ķ��Ӽ�������ǿ
D. �����ӵİ뾶��N >X������Ϊ���Ǿ�����ͬ�ĵ��Ӳ�ṹ��X�ĺ˵��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com