
【题目】利用如图所示装置进行下列实验,不能达到相应实验目的的是( )
选项 | ① | ② | ③ | 实验目的 |
|
A | 稀硫酸 | Na2S | AgCl的浊液 | 验证Ag2S比AgCl难溶 | |
B | 浓硝酸 | Cu片 | NaOH溶液 | 探究浓硝酸具有氧化性 | |
C | 硫酸 | Na2SO3 | 酸性KMnO4溶液 | 探究SO2具有还原性 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 验证酸性:硝酸>碳酸>硅酸 |
A.AB.BC.CD.D
【答案】D
【解析】
A. 在装置②中H2SO4与Na2S发生复分解反应产生H2S气体,气体进入③中与AgCl悬浊液发生反应产生Ag2S黑色沉淀,从而可证明Ag2S比AgCl更难溶,A正确;
B. 浓硝酸与Cu反应产生Cu(NO3)2、红棕色气体NO2、H2O,NaOH溶液吸收NO2气体,变为NaNO3、NaNO2和水,从而防止了大气污染。在HNO3中N元素为+5价,反应后变为NO2中的+4价,元素化合价降低,得到电子,被还原,从而可证明浓硝酸具有氧化性,B正确;
C. 硫酸与Na2SO3发生复分解反应产生SO2气体,SO2气体通入到酸性KMnO4溶液中,看到溶液紫色褪色,可证明SO2具有还原性,C正确;
D. 浓硝酸与Na2CO3在溶液中发生复分解反应产生CO2气体,证明酸性:HNO3>H2CO3;但由于浓硝酸具有挥发性,挥发的硝酸蒸气进入装置③中,会发生反应:2HNO3+Na2SiO3=H2SiO3↓+ 2NaNO3,得到结论酸性:HNO3>H2SiO3;在③中CO2气体也会发生反应:CO2+H2O+Na2SiO3=H2SiO3↓+ Na2CO3,产生白色硅酸沉淀,因此不能证明白色沉淀是那种物质反应产生,故不能得到结论:酸性:HNO3>H2CO3> H2SiO3,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,如图所示是有关合成路线图.
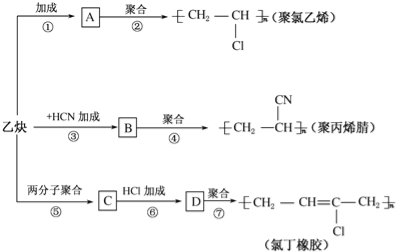
已知反应:nCH2═CH﹣CH═CH2![]()
![]()
请完成下列各题:
(1)写出物质的结构简式:A ,C .
(2)写出反应的化学方程式
反应②: ;
反应③: ;
反应⑥: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图所示装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体,(图中夹持及尾气处理装置均已略去)回答下列问题:
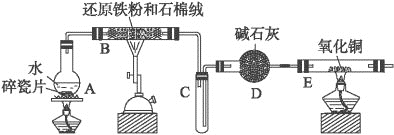
(1)装置B中发生反应的化学方程式是___;
(2)B、E两处酒精灯,必须后点燃的是___;
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液里含有Fe3+,选用的试剂为__,现象是__。
②该实验小组同学用上述试剂没有检验到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化与氧化还原反应无关的是( )
A.向FeCl3溶液中滴加KSCN溶液,溶液变红
B.金属钠投入水中,有气体产生
C.将盛有氯气的试管倒扣在水中,水位上移
D.向H2S溶液中通入SO2气体,产生淡黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已经达到平衡的反应 2X(g)+Y(g)![]() 2Z(g) ΔH<0 ,下列说法正确的是( )
2Z(g) ΔH<0 ,下列说法正确的是( )
A.缩小容器体积,正、逆反应速率都增大,平衡向逆反应方向移动
B.升高反应温度,该反应的平衡常数增大
C.改变条件使平衡正向移动,反应物的转化率一定都增大
D.加入催化剂,可以降低反应所需的活化能,但不改变反应的ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应aX(g) ![]() bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
A. 可逆反应的化学计量数:a>b+c
B. 达到新平衡时,物质X的转化率减小
C. 压缩容器的容积时,υ正增大,υ逆减小
D. 达到新平衡时,混合物中Z的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量浓度配制说法正确的是
A.定容时,直接加水至刻度线,当凹液面与刻度线相切时,停止加水
B.向容量瓶中转移液体前容量瓶未烘干,所配得的浓度偏低
C.配制一定物质的量浓度的氢氧化钠溶液,移液时未冷却,所配得的浓度偏低
D.配制一定物质的量浓度的硫酸溶液,量取浓硫酸时仰视读数,所配得的浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验(如图)。
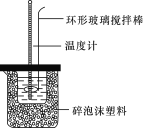
(1)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还应加入的试剂是________(填序号)。
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
(2)在实验过程中,该同学需要测定并记录的实验数据有_____________(填序号)。
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.溶液混合后的最高温度
(3)若用50 mL 0.5 mol·L-1醋酸溶液代替上述盐酸测定中和热,所得数据_____________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
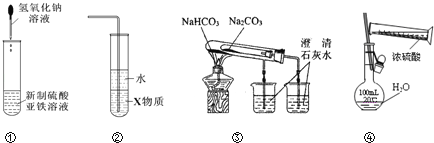
A.利用装置①可制备氢氧化亚铁并长时间观察其颜色
B.装置②中X若为四氯化碳,可用于吸收HCl气体,并防止倒吸
C.装置③验证Na2CO3和NaHCO3两种固体的热稳定性
D.通过④的方法配制一定浓度的稀硫酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com