
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A. 标准状况下,3.36LCCl4中含有,7.5NA个原子
B. 常温常压下,32gO2和O3的混合物中含有的氧原子数约为1.204×1024
C. CO2和标准状况下11.2LHCl具有相同的原子数
D. 1L0.1mol/L的CH3COOH溶液中,H+的数目为0.1NA
科目:高中化学 来源: 题型:
【题目】镇痛药物J的合成方法如下:

已知:

(1)B的名称为_________________;F的结构简式为_______________。
(2)C中含氧官能团名称为_______________;②的反应类型为____________反应。
(3)③的化学方程式为_______________________________ 。
(4)有机物K分子组成比F少两个氢原子,符合下列要求的K的同分异构体有________种。
A.遇FeCl3显紫色 B.苯环上有三个取代基
(5)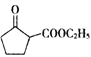 是一种重要的化工中间体。以环已醇(
是一种重要的化工中间体。以环已醇(![]() )和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出
)和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出 的合成路线____________________。(已知:RCH=CHR’
的合成路线____________________。(已知:RCH=CHR’![]() RCOOH+R’COOH,R、R'为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
RCOOH+R’COOH,R、R'为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各实验中需用浓盐酸而不宜用稀盐酸,请写出反应的化学方程式并阐明理由。
(1)配制SnCl2溶液时,将SnCl2(s)溶于浓盐酸后再加水稀释______。
(2)加热MnO2与浓盐酸的混合物制取氯气______。
(3)需用浓盐酸与浓硝酸混合配制王水才能溶解金(生成HAuCl4)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用,根据题意回答下列问题:
I工业上制备Na2S的反应原理如下
①Na2SO4(s)===Na2S(s)+2O2(g) △H1=+1011.0kJ·mol-1
②C(s)+O2(g)===CO2(g) △H2=-393.5kJ·mol-1
③2C(s)+O2(g)===2CO(g) △H3=-221.0kJ·mol-1
④Na2SO4(s)+4C(s)===Na2S(s)+4CO(g) △H4
(1)△H4=___________ kJ·mol-1。
(2)反应④能自发进行的条件是___________。
(3)工业上制备Na2S不用反应①,而用反应④的理由是_____________________________。
Ⅱ.在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生反应:2NO(g)+2C0(g) ![]() 2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
时间(s) | 0 | 10 | 20 | 30 | 40 | …… |
C(NO)/mol/L | 0.100 | 0.050 | 0.025 | 0.010 | 0.010 | …… |
(1)计算此温度下该反应的K=______________________。
(2)达到平衡时,下列措施能提高NO转化率的是___________(填序号)。
A.选用更有效的催化剂
B.降低反应体系的温度
C.充入氩气使容器内压强增大
D.充入CO使容器内压强增大
Ⅲ.工业上常用臭氧处理含NO2-的废水。
(1)O3氧化NO2-可产生NO3-和O2,反应中每生成1mol的O2转移___________mol电子。
(2)O3可由电解稀硝酸制得,原理如图。图中阴极为___________(填“A”或“B”),阳极(惰性电极)的电极反应式为____________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先 将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是( )

A. 试剂Ⅰ是Ba(NO3)2溶液,试剂Ⅲ是HCl溶液
B. ①②③的操作均为过滤
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. Y和Z中都含有BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.所配的标准NaOH溶液物质的量浓度偏大
(2)判断滴定终点的现象是_____________________________________。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com