
ЁОЬтФПЁПеђЭДвЉЮяJЕФКЯГЩЗНЗЈШчЯТЃК

вбжЊЃК

(1)BЕФУћГЦЮЊ_________________ЃЛFЕФНсЙЙМђЪНЮЊ_______________ЁЃ
(2)CжаКЌбѕЙйФмЭХУћГЦЮЊ_______________ЃЛЂкЕФЗДгІРраЭЮЊ____________ЗДгІЁЃ
(3)ЂлЕФЛЏбЇЗНГЬЪНЮЊ_______________________________ ЁЃ
(4)гаЛњЮяKЗжзгзщГЩБШFЩйСНИіЧтдзгЃЌЗћКЯЯТСавЊЧѓЕФKЕФЭЌЗжвьЙЙЬхга________жжЁЃ
AЃЎгіFeCl3ЯдзЯЩЋ BЃЎБНЛЗЩЯгаШ§ИіШЁДњЛљ
(5)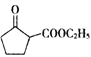 ЪЧвЛжжживЊЕФЛЏЙЄжаМфЬхЁЃвдЛЗвбДМ(
ЪЧвЛжжживЊЕФЛЏЙЄжаМфЬхЁЃвдЛЗвбДМ(![]() )КЭввДМЮЊЦ№ЪМдСЯЃЌНсКЯМКжЊаХЯЂбЁдёБивЊЕФЮоЛњЪдМСЃЌаДГі
)КЭввДМЮЊЦ№ЪМдСЯЃЌНсКЯМКжЊаХЯЂбЁдёБивЊЕФЮоЛњЪдМСЃЌаДГі ЕФКЯГЩТЗЯп____________________ЁЃ(вбжЊЃКRCH=CHRЁЏ
ЕФКЯГЩТЗЯп____________________ЁЃ(вбжЊЃКRCH=CHRЁЏ![]() RCOOH+RЁЏCOOHЃЌRЁЂR'ЮЊЬўЛљЁЃгУНсЙЙМђЪНБэЪОгаЛњЮяЃЌгУМ§ЭЗБэЪОзЊЛЏЙиЯЕЃЌМ§ЭЗЩЯзЂУїЪдМСКЭЗДгІЬѕМў)
RCOOH+RЁЏCOOHЃЌRЁЂR'ЮЊЬўЛљЁЃгУНсЙЙМђЪНБэЪОгаЛњЮяЃЌгУМ§ЭЗБэЪОзЊЛЏЙиЯЕЃЌМ§ЭЗЩЯзЂУїЪдМСКЭЗДгІЬѕМў)
ЁОД№АИЁП3-ТШБћЯЉ(Лђ3-ТШ-1-БћЯЉ) ![]() ѕЅЛљ ШЁДњ
ѕЅЛљ ШЁДњ 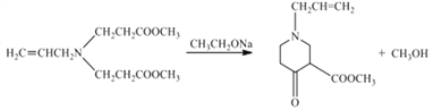 30
30 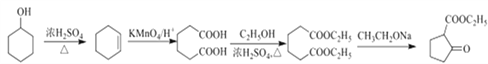
ЁОНтЮіЁП
гЩ![]() ФцЭЦЃЌПЩжЊBЪЧ
ФцЭЦЃЌПЩжЊBЪЧ![]() ЁЂAЪЧ
ЁЂAЪЧ![]() ЃЛ
ЃЛ
![]() ЃЌНсКЯ
ЃЌНсКЯ![]() ЃЌПЩжЊCЪЧ
ЃЌПЩжЊCЪЧ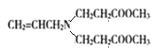 ЃЛгЩ
ЃЛгЩ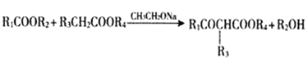 ЃЌ
ЃЌ![]() ЃЌдђDЪЧ
ЃЌдђDЪЧ ЃЌDдкЯЁСђЫсжаЫЎНтЮЊE
ЃЌDдкЯЁСђЫсжаЫЎНтЮЊE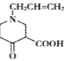 ЃЛИљОн
ЃЛИљОн ЃЌФцЭЦFЮЊ
ЃЌФцЭЦFЮЊ![]() ЁЃ
ЁЃ
ИљОнвдЩЯЗжЮіЃЌ(1)BЪЧ![]() ЃЌУћГЦЮЊ3-ТШБћЯЉЃЛFЕФНсЙЙМђЪНЮЊ
ЃЌУћГЦЮЊ3-ТШБћЯЉЃЛFЕФНсЙЙМђЪНЮЊ![]() ЁЃ
ЁЃ
(2)CЪЧ ЃЌКЌбѕЙйФмЭХУћГЦЮЊѕЅЛљЃЛЗДгІЂкЪЧ
ЃЌКЌбѕЙйФмЭХУћГЦЮЊѕЅЛљЃЛЗДгІЂкЪЧ![]() ДњЬц
ДњЬц![]() жаАБЛљЩЯЕФЧтдзгЃЌЗДгІРраЭЮЊШЁДњЗДгІЁЃ
жаАБЛљЩЯЕФЧтдзгЃЌЗДгІРраЭЮЊШЁДњЗДгІЁЃ
(3)ЗДгІЂлЪЧ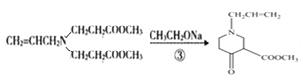 ЃЌЛЏбЇЗНГЬЪНЮЊ
ЃЌЛЏбЇЗНГЬЪНЮЊ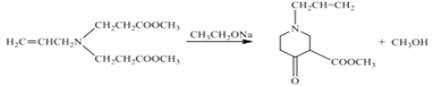 ЁЃ
ЁЃ
(4)гіFeCl3ЯдзЯЩЋЃЌЫЕУїКЌгаЗгєЧЛљЃЛБНЛЗЩЯЕФШ§ИіШЁДњЛљЗжБ№ЪЧ![]() Лђ
Лђ![]() Лђ
Лђ![]() ЃЌУПжжзщКЯдкБНЛЗЩЯЕФЮЛжУвьЙЙга10жжЃЌЫљвдЗћКЯвЊЧѓЕФKЕФЭЌЗжвьЙЙЬхЙВ30жжЁЃ
ЃЌУПжжзщКЯдкБНЛЗЩЯЕФЮЛжУвьЙЙга10жжЃЌЫљвдЗћКЯвЊЧѓЕФKЕФЭЌЗжвьЙЙЬхЙВ30жжЁЃ
(5)ИљОнЬтИЩЕФСїГЬЃЌвдЛЗвбДМ(![]() )КЭввДМЮЊЦ№ЪМдСЯКЯГЩ
)КЭввДМЮЊЦ№ЪМдСЯКЯГЩ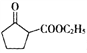 ЃЌЪзЯШНЋЛЗМКДМзЊЛЏЮЊЛЗМКЯЉЃЌШЛКѓИљОнЬтжааХЯЂНЋЛЗМКЯЉбѕЛЏЮЊМКЖўЫсЃЌНгзХЗЂЩњѕЅЛЏЗДгІжЦБИМКЖўЫсЖўввѕЅЃЌзюКѓИљОнЬтжаЗДгІЂлЕФаХЯЂЗЂЩњШЁДњЗДгІжЦБИВњЦЗЁЃОпЬхКЯГЩТЗЯпЪЧЃК
ЃЌЪзЯШНЋЛЗМКДМзЊЛЏЮЊЛЗМКЯЉЃЌШЛКѓИљОнЬтжааХЯЂНЋЛЗМКЯЉбѕЛЏЮЊМКЖўЫсЃЌНгзХЗЂЩњѕЅЛЏЗДгІжЦБИМКЖўЫсЖўввѕЅЃЌзюКѓИљОнЬтжаЗДгІЂлЕФаХЯЂЗЂЩњШЁДњЗДгІжЦБИВњЦЗЁЃОпЬхКЯГЩТЗЯпЪЧЃК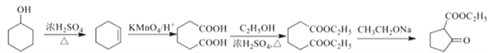 ЁЃ
ЁЃ


 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЉНЈжўВФСЯКЌгаЗХЩфаддЊЫиыБ22286RnЃЌЛсЖдШЫЬхВњЩњвЛЖЈЮЃКІЁЃбаОПБэУїыБЕФІСЩфЯпЛсжТАЉЃЌWHOШЯЖЈЕФ19жжжТАЉвђЫижаЃЌыБЮЊЦфжажЎвЛЃЌНіДЮгкЮќбЬЁЃИУдзгЕФжазгЪ§гыжЪзгЪ§жЎКЭМАжЎВюЗжБ№ЪЧ
A. 136ЃЌ86B. 50ЃЌ136
C. 222 ЃЌ 50D. 222ЃЌ86
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)ШчЭМЫљЪОЃЌНЋТШЦјвРДЮЭЈЙ§ЪЂгаИЩдягаЩЋВМЬѕЕФЙуПкЦПКЭЪЂгаГБЪЊгаЩЋВМЬѕЕФЙуПкЦПЃЌПЩЙлВьЕНЕФЯжЯѓЪЧ ______________ЁЃ

(2)ЮЊЗРжЙТШЦјЮВЦјЮлШОПеЦјЃЌПЩгУ________ШмвКЮќЪеЖргрЕФТШЦјЃЌдРэЪЧ(гУЛЏбЇЗНГЬЪНБэЪО)____________________ЁЃ
(3)ЙЄвЕЩЯГЃгУСЎМлЕФЪЏЛвШщЮќЪеЙЄвЕТШЦјЮВЦјжЦЕУЦЏАзЗлЃЌЦЏАзЗлЕФгааЇГЩЗжЪЧ_______(ЬюЛЏбЇЪН),ГЄЦкТЖжУгкПеЦјжаЕФЦЏАзЗлЃЌМгЯЁбЮЫсКѓВњЩњЕФЦјЬхЪЧ_______(гУзжФИДњКХЬю)ЁЃ
AЃЎO2 BЃЎCl2 CЃЎCO2 DЃЎHClO
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУШчЭМЫљЪОзАжУЗжБ№НјааЯТСаИїзщЮяжЪЕФЕМЕчадЪЕбщ,аЁЕЦХнЕФССЖШБШЗДгІЧАУїЯдМѕШѕЕФЪЧ

A. ЯђбЧСђЫсФЦШмвКжаЭЈШыТШЦј
B. ЯђЯѕЫсвјШмвКжаЭЈШыЩйСПТШЛЏЧт
C. ЯђЧтЕтЫсБЅКЭШмвКжаЭЈШыЩйСПбѕЦј
D. ЯђЧтбѕЛЏФЦШмвКжаЭЈШыЩйСПТШЦј
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЂёЁЂИљОнЗжзгжаЫљКЌЙйФмЭХПЩдЄВтгаЛњЛЏКЯЮяЕФаджЪЁЃ
ЃЈ1ЃЉЯТСаЛЏКЯЮяжаЃЌГЃЮТЯТвзБЛПеЦјбѕЛЏЕФЪЧ______ЃЈЬюзжФИЃЉЁЃ
a.БН b.МзБН c.БНМзЫс d.БНЗг
ЃЈ2ЃЉБНввЯЉЪЧвЛжжживЊЮЊгаЛњЛЏЙЄдСЯЁЃ
ЂйБНввЯЉЕФЗжзгЪНЮЊ______ЁЃ
ЂкБНввЯЉдквЛЖЈЬѕМўЯТФмКЭЧтЦјЭъШЋМгГЩЃЌМгГЩВњЮяЕФвЛфхШЁДњЮяга______жжЁЃ
ЂђЁЂАДвЊЧѓаДГіЯТСаЗДгІЕФЛЏбЇЗНГЬЪНЃК
ЃЈ1ЃЉ(CH3)2C(OH)CH(OH)CH2OHЗЂЩњДпЛЏбѕЛЏЗДгІЃК___________________ЁЃ
ЃЈ2ЃЉ1,2-ЖўфхБћЭщЗЂЩњЭъШЋЕФЯћШЅЗДгІЃК_______________________________ЁЃ
ЃЈ3ЃЉ![]() ЗЂЩњвјОЕЗДгІЃК_______________________________ЁЃ
ЗЂЩњвјОЕЗДгІЃК_______________________________ЁЃ
Ђѓ. ЫЎбюЫсЕФНсЙЙМђЪНЮЊЃК ЃЌгУЫќКЯГЩЕФАЂЫОЦЅСжЕФНсЙЙМђЪНЮЊЃК
ЃЌгУЫќКЯГЩЕФАЂЫОЦЅСжЕФНсЙЙМђЪНЮЊЃК
ЃЈ1ЃЉЧыаДГіНЋ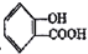 зЊЛЏЮЊ
зЊЛЏЮЊ![]() ЕФЛЏбЇЗНГЬЪН__________________ЁЃ
ЕФЛЏбЇЗНГЬЪН__________________ЁЃ
ЃЈ2ЃЉАЂЫОЦЅСжгызуСПNaOHШмвКЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪН___________________ЁЃ
ЃЈ3ЃЉЫЎбюЫсгыЮоЫЎввДМЗЂЩњѕЅЛЏЗДгІЕФЛЏбЇЗНГЬЪН_____________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПXЁЂYЁЂZЁЂWЁЂQЮЊдзгађЪ§вРДЮдіДѓЕФЧАЫФжмЦкдЊЫиЃЌXКЫЭтЮДГЩЖдЕчзгЪ§га2ИіЃЌгыЦфЫћдЊЫиОљФмаЮГЩЖўдЊЛЏКЯЮяЃЛYЪЧЕиПЧжаКЌСПзюЖрЕФН№ЪєдЊЫиЃЛZЪЧвХДЋЮяжЪЕФзщГЩдЊЫижЎвЛЃЛWФкВуЕчзгЪ§ЪЧзюЭтВуЕчзгЪ§ЕФ9БЖЃЛQЛљЬЌдзгМлВуЕчзгХХВМжаГЩЖдЕчзгЪ§КЭЮДГЩЖдЕчзгЪ§ЯрЭЌЃЌЧвГЩЖдЕчзгЪ§ЮЊзюЭтВуЕчзгЪ§ЕФ2БЖЁЃОнДЫЛиД№ЯТСаЮЪЬт:
ЃЈ1ЃЉQЕФЛљЬЌдзгЕФМлВуЕчзгХХВМЪНЮЊ___________________________ЁЃ
ЃЈ2ЃЉXЁЂYЁЂZЁЂWЫФжждЊЫижаЃЌЕчИКадзюДѓЕФЪЧ_________(ЬюдЊЫиЗћКХ,ЯТЭЌ)ЃЛЭЌжмЦкдЊЫижаЃЌЕквЛЕчИпФмНщгкYКЭZжЎМфЕФга__________________ЁЃ
ЃЈ3ЃЉYКЭWЕФТШЛЏЮяШлЕуИпЕФЪЧ______(ЬюЛЏбЇЪН)ЃЌдвђЪЧ_____________________ЃЛгыZЕФЕЭМлТШЛЏЮяЛЅЮЊЕШЕчзгЬхЕФРызгЪЧ_______(ЬюРызгЗћКХ)ЁЃ
ЃЈ4ЃЉПЇЗШвђЖджаЪрЩёОгааЫЗмзїгУЃЌЦфНсЙЙМђЪНШчЭМЫљЪОЁЃГЃЮТЯТЃЌПЇЗШвђдкЫЎжаЕФШмНтЖШЮЊ2gЃЌМгЪЪСПЫЎбюЫсФЦ[C6H4(OH)(COONa)]ПЩЪЙЦфШмНтЖШдіДѓЃЌЦфдвђПЩФмЪЧ___________ЃЌЗжзгжаЕЊдзгЕФдгЛЏРраЭга___________________ЁЃ

ЃЈ5ЃЉвбжЊWXЕФУмЖШЮЊ3.25g/cm3ЃЌЕЅдЊОЇАћБпГЄ481pmЃЌОМЦЫуПЩШЗЖЈИУЕЅдЊОЇАћжаКЌга____ИіWXЃЌЫЕУїдкаЮГЩОЇЬхЪБЃЌАыОЖДѓЕФСЃзгЯШНјааСЫ_______ЗНЪНЕФЖбЛ§ЃЌОЇАћжаОрРыWзюНќЕФXга_____ИіЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСЌЖўбЧСђЫсФЦ(Na2S2O4)ЫзГЦБЃЯеЗлЃЌЪЧвЛжжЧПЛЙдМСЁЃЙЄвЕГЃгУЖшадЕчМЋЕчНтбЧСђЫсЧтФЦЕФЗНЗЈжЦБИСЌЖўбЧСђЫсФЦЃЌдРэзАжУШчЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
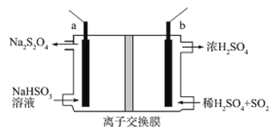
A. bЕчМЋгІИУНгЕчдДЕФИКМЋ
B. зАжУжаЫљгУРызгНЛЛЛФЄЮЊвѕРызгНЛЛЛФЄ
C. ЕчТЗжаУПзЊвЦ1mole-ЯћКФSO2ЕФЬхЛ§ЮЊ11.2L
D. aЕчМЋЕФЕчМЋЗДгІЪНЮЊЃК2HSO3-+2e-+2H+=S2O42-+2H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊФЦЁЂТШМАЦфЛЏКЯЮяМфгаШчЯТзЊЛЏЙиЯЕЃЌ
ЧыАДвЊЧѓЬюПеЃК
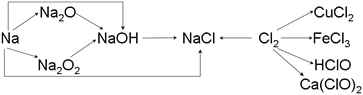
ЃЈ1ЃЉЪЕбщЪвжаН№ЪєФЦЭЈГЃБЃДцдк_______жаЃЌвЛаЁПщН№ЪєФЦЭЖШыЫЎжаЗДгІЕФЛЏбЇЗНГЬЪНЪЧ________________ЁЃ
ЃЈ2ЃЉNa2O2ГЃгУгкКєЮќУцОпжаЃЌгаЙиЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________________________ЃЌ_________________________________ЁЃ
ЃЈ3ЃЉаТжЦЕФТШЫЎЕЮШызЯЩЋЪЏШяЪдвКжаЃЌЙлВьЕНЕФЯжЯѓЪЧ___________________________ЁЃ
ЧыаДГіТШЦјгыЫЎЗДгІЕФЛЏбЇЗНГЬЪН_______________________________ЁЃ
ЃЈ4ЃЉЙЄвЕЩЯгУТШЦјКЭЪЏЛвШщЗДгІжЦЦЏАзЗлЃЌЦфЛЏбЇЗНГЬЪНЮЊ_____________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЃЌЯТСаа№Ъіжае§ШЗЕФЪЧЃЈ ЃЉ
A. БъзМзДПіЯТЃЌ3.36LCCl4жаКЌгаЃЌ7.5NAИідзг
B. ГЃЮТГЃбЙЯТЃЌ32gO2КЭO3ЕФЛьКЯЮяжаКЌгаЕФбѕдзгЪ§дМЮЊ1.204ЁС1024
C. CO2КЭБъзМзДПіЯТ11.2LHClОпгаЯрЭЌЕФдзгЪ§
D. 1L0.1mol/LЕФCH3COOHШмвКжаЃЌH+ЕФЪ§ФПЮЊ0.1NA
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com