
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________。
(2)X、Y、Z、W四种元素中,电负性最大的是_________(填元素符号,下同);同周期元素中,第一电高能介于Y和Z之间的有__________________。
(3)Y和W的氯化物熔点高的是______(填化学式),原因是_____________________;与Z的低价氯化物互为等电子体的离子是_______(填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的杂化类型有___________________。

(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____个WX,说明在形成晶体时,半径大的粒子先进行了_______方式的堆积,晶胞中距离W最近的X有_____个。
【答案】 3d64s2 O Mg、Si、S CaCl2 CaCl2属于离子晶体,钙离子和氯离子之间作用大,熔点高,AlC13属于分子晶体,分子间作用力弱 SO32-或ClO3- 咖啡因与水杨酸钠形成了氢键 sp2和sp3 4个 面心立方最密堆积 6
【解析】根据题目所述可知X为O元素,Y是Al元素,Z是P元素,W内层电子数是最外层电子数的9倍,则只能是Ca元素,所以Q为第四周期元素,其基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍,即Q的价层电子排布为3d64s2,所以Q为26号元素Fe。
(1)Fe的基态原子的价层电子排布式为3d64s2;答案:3d64s2。
(2)在这四种元素中,电负性最大的是O元素;根据同周期从左到右第一电离能逐渐增大的变化规律,同时还要考虑ⅡA族的3s2全满状态和ⅤA族3s23p3半满状态的稳定性,得出第一电离能介于Al和P之间的同周期元素有Mg、Si和S三种元素;答案:O Mg、Si、S 。
(3)由于CaCl2是离子化合物,Ca2+和Cl—之间的离子键作用力大,所以CaCl2的熔点高,而AlCl3是分子晶体,分子间作用力小,所以熔点低;Z的低价氯化物为PCl3,其分子中的最外层电子数为26,与它互为等电子体的离子为SO32—或ClO3—;答案:CaCl2 CaCl2属于离子晶体,钙离子和氯离子之间作用大,熔点高,AlC13属于分子晶体,分子间作用力弱。SO32-或ClO3-。
(4)水杨酸钠分子中有羟基,而咖啡因分子中有N、O两种吸引电子能力很强的元素,所以二种分子之间可形成氢键,使其溶解度增大;咖啡因分子中N原子有形成双键的sp2杂化,也有形成单键的sp3杂化;答案: 咖啡因与水杨酸钠形成了氢键 sp2和sp3。
(5)已知CaO晶体的密度为3.25g/cm3,晶胞边长481pm,则体积为(4.81×10-8)3=1.11×10-22cm3,所以晶胞的摩尔质量为3.25g/cm3×1.11×10-22cm3×6.02×1023mol-1=218g/mol,即该晶胞中含有4个CaO;属于面心立方结构,根据面心结构的特点可推知,晶胞中距离Ca2+最近的O2-有6个,分别在Ca2+的前后、上下、左右六个位置上。答案:4个 面心立方最密堆积 6


科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A.1:2
B.1:4
C.3:4
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.光合作用是将光能转化为化学能的有效途径
B.煤,石油,天然气都是可再生的化石燃料
C.用植物秸秆制沼气是有效利用生物质能的方式之一
D.开发氢能,太阳能,风能,生物质能等是实现“低碳生活”的有效途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)2Z(g),各组分在不同时刻的浓度如表:
物质 | X | Y | Z |
初始浓度/(molL﹣1) | 0.1 | 0.2 | 0 |
2min末浓度/(molL﹣1) | 0.08 | a | b |
平衡浓度/(molL﹣1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A.平衡时,X的转化率为5%
B.t℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v(正)增大,v(逆)减小,平衡向正反应方向移动
D.2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ·mol-1
I.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.l | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.l | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]XCat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比。
已知:①CO和H2的标准燃烧热分别为-283.0kJ/mol和一285.8kJ/mol;
②H2O(l)==H2O(g) △H3=+44.0kJ·mol-1
请回答下列问题(不考虑温度对△H的影响):
(1)反应I在_________(填“低温”或“高温”)下自发进行;反应II每生成9g水蒸气放出热量为___________。
(2)恒容条件下,有利于提高CO2转化为CH3OH的平衡转化率的措施有_____(填字母代号)。
A.延长反应时间 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)由表中实验数据可以得出的结论是_______________________。
(4)553K,使用催化剂Cat.2,在该时刻H2的转化率为______(填字母代号)。
A.5.5% B.13.3% C.16.4% D.29.3%
(5)在下图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。________
(6)研究证实,CO2也可在硫酸溶液中用情性电解生成甲醇,则生成甲醇的电极反应式是_________,另一极的电解产物为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
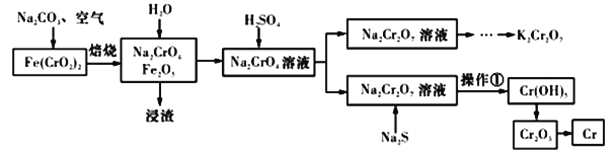
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________。焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)判断加入稀硫酸的量已经足量的标准是_______________________________________。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是调节溶液的酸碱度和_____________________。
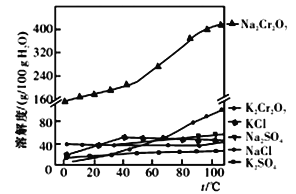
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合上图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水):
步骤①除杂质:__________________________________________________________________;
步骤②制备K2Cr2O7固体:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时四种酸的电离平衡常数:
化学式 | CH3COOH | HA | HNO2 | H2CO3 |
Ka | Ka=1.8×10﹣5 | Ka=4.9×10﹣10 | Ka=4.6×10﹣4 | Ka1 =4.1×10﹣7 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)25℃时,向向0.1molL﹣1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液pH=
(3)写出NaA溶液中通少量CO2的离子方程式
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2 , 某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法(填“可行”或“不可行”),理由是
(6)已知NaHCO3溶液中存在HCO3H++CO32﹣ , 加水稀释时溶液中的c(H+)将(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池广泛应用于电动自行车电源,其工作原理如图所示,LixC6和Li1-xFePO4为电极材料,电池反应式为: LixC6+Li1-xFePO4=LiFePO4+6C(x<1)。下列说法错误的是
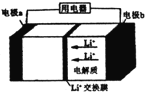
A. 放电时,电极b是负极
B. 放电时,电路中通过0.2mol电子,正极会增重1.4g
C. 充电时,电极a的电极反应式为:6C+xLi++xe-=LixC6
D. 若Li1-xFePO4电极中混有铁单质,会造成电池短路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.丙烷分子中3个碳原子一定在同一条直线上
B.甲苯分子中7个碳原子都在同一平面上
C.3—甲基—1—丁炔分子中所有碳原子都在同一平面上
D.2-丁烯分子中4个碳原子有可能在同一条直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com