
����Ŀ��(1)��ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ�г�ʪ��ɫ�����Ĺ��ƿ���ɹ۲쵽�������� ______________��

(2)Ϊ��ֹ����β����Ⱦ����������________��Һ���ն����������ԭ����(�û�ѧ����ʽ��ʾ)____________________��
(3)��ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�Ư�۵���Ч�ɷ���_______(�ѧʽ),����¶���ڿ����е�Ư�ۣ���ϡ����������������_______(����ĸ������)��
A��O2 B��Cl2 C��CO2 D��HClO
���𰸡��������ɫ��������������ʪ����ɫ������ɫ NaOH Cl2+2NaOH=NaCl+NaClO+H2O Ca(ClO)2 C
��������
���⿼��������Ư���ԣ��������ķ�Ӧ�Լ�Ư��ʧЧ��ԭ�����ش�ʱҪע�����ԵĹ淶���Ͻ���
��1�����������û��Ư�����ã���ʪ����������Ϊ������ˮ��Ӧ�����˴����������Ư�����á����ԣ�����������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ�г�ʪ��ɫ�����Ĺ��ƿ���ɹ۲쵽�������ǣ��������ɫ��������������ʪ����ɫ������ɫ��
��2��Ϊ��ֹβ���е�������Ⱦ������ͨ����ŨNaOH��Һ�������գ���Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O��
��3����ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O��Ư�۵���Ҫ�ɷ���Ca(ClO)2��CaCl2����Ч�ɷ���Ca(ClO)2��Ư�۳���¶���ڿ����л���CO2��ˮ��Ӧ��Ca(ClO)2+CO2+H2O=CaCO3+2HClO�����ù����м�ϡ���������Ӧ��CaCO3+2HCl=CaCl2+H2O+CO2����������������Ҫ��CO2���塣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ظ�����(Na2Cr2O7)�ᾧ���ĸҺ(����������Fe3+)�����ظ���� (K2Cr2O7)���乤�����̼���������ܽ����������ͼ��ʾ��


��1����Na2Cr2O7ĸҺ�мӼ�Һ��pH��Ŀ����_____________________��
��2��ͨ����ȴ�ᾧ��������K2Cr2O7��ԭ����________________________________��
��3������A����Ҫ�ɷ�Ϊ__________���ѧʽ��������ˮϴ�ӹ���A�����յ�ϴ��Һת�Ƶ�ĸҺ___________(�I������)�У�������߲����ֿ�ʹ�ܺĽ��͡�
��4���ⶨ��Ʒ��K2Cr2O7�����ķ������£���ȡ��Ʒ����2.500 g ���250 mL��Һ������Һ��ȡ��25.00 mL�ڵ���ƿ�У�����10 mL 2 mol��L-l H2SO4��Һ������KI��Һ(���Ļ�ԭ����ΪCr3+)�������ڰ���5 min��Ȼ�����100 mL����ˮ��3 mL ����ָʾ������0.1200 mol��L-l Na2S2O3����Һ�ζ�(��֪I2+ 2S2O32-=2I-+S4O62-)��
��������Һ��KI ��K2Cr2O7��Ӧ�����ӷ���ʽΪ_____________________________��
����ʵ���й���ȥNa2S2O3����Һ40.00 mL�������ò�Ʒ���ظ���صĴ���Ϊ__________%( ����2 λС�����������������������ʲ����뷴Ӧ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���ھ�����ˮ��ͬʱ�ܻ����Դ��õ��м�ֵ�Ļ�ѧ��Ʒ����ͼΪ�乤��ԭ������ͼΪ��ˮ��Cr2O72-����Ũ����ȥ���ʵĹ�ϵ������˵������ȷ����
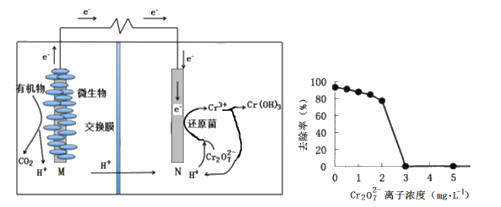
A. �л��ﱻ������MΪ��Դ����
B. ��ع���ʱ��N��������ҺpH����
C. Cr2O72-����Ũ�Ƚϴ�ʱ�����ܻ���ɻ�ԭ��ʧ��
D. ����0.1 mol Cr2O72��ʱ��1.4 mol H���ӽ���Ĥ������Ҳ�Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ��ѧʵ���������ã�ij��ѧ��ʦΪ������������Ʒ�Ӧ�����������װ��������������صĿα�ʵ�顣�ȸ���Ԥ�ȣ��������ڳ�Բ��ʱ������ͨ�����������ɼ����Ż�ȼ�գ����ɴ������̡�

���������������
A. ��Ӧ���ɵĴ����������Ȼ��ƾ���
B. ������β����һ�Ž���NaOH��Һ���������������չ�����������������Ⱦ����
C. ���Ż�ȼ�ղ�����ɫ����
D. �������ص�һ�ε��۵⻯����Һ���ɾ�����ɫ�仯�ж������Ƿ�Һ��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PCl5��������ӦPCl5(g)![]() PCl3(g)+Cl2(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
PCl3(g)+Cl2(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. ��Ӧ��ǰ50 s ��ƽ��������(Cl2)= 0. 0032 mol��L-1��s-1
B. ���������������䣬�����¶ȣ�ƽ��ʱc(PCl3)= 0. 13 mol��L-1����Ӧ����H<0
C. ��ͬ�¶��£���ʼʱ�������г���1. 0 mol PCl5��0. 20 mol PCl3 ��0. 20 mol Cl2 ����Ӧ�ﵽƽ��ǰ��(��)<��(��)
D. ��ͬ�¶��£���ʼʱ�������г���2. 0 mol PCl3 ��2. 0 mol Cl2 ���ﵽƽ��ʱ��PCl3 ��ת���ʴ���80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������;��˵���У�����ȷ����
A.75%���Ҵ���Һ��ҽ��������B.Fe3O4������ɫ�����Ϳ��
C.ClO2����������ˮ������D.Na2O2����������ߵȵĹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�A�ǿ�����������ˮ���������Ļ���ɫ�������壬A��B��C��D��E����XԪ�أ���ת����ϵ��ͼ��ʾ��

(1)��ֱ�д���������ʵĻ�ѧʽ(��Ϊ��Һ�������ʵĻ�ѧʽ)��
A________�� B________�� D________��E________��
(2)д�����з�Ӧ�Ļ�ѧ����ʽ(��ע����Ӧ����)��
A��H2O�� ____________________��
A �� D�� ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹҩ��J�ĺϳɷ������£�

��֪��

(1)B������Ϊ_________________��F�Ľṹ��ʽΪ_______________��
(2)C�к�������������Ϊ_______________���ڵķ�Ӧ����Ϊ____________��Ӧ��
(3)�۵Ļ�ѧ����ʽΪ_______________________________ ��
(4)�л���K������ɱ�F��������ԭ�ӣ���������Ҫ���K��ͬ���칹����________�֡�
A����FeCl3����ɫ B��������������ȡ����
(5)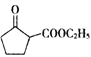 ��һ����Ҫ�Ļ����м��塣�Ի��Ѵ�(
��һ����Ҫ�Ļ����м��塣�Ի��Ѵ�(![]() )���Ҵ�Ϊ��ʼԭ�ϣ���ϼ�֪��Ϣѡ���Ҫ�����Լ���д��
)���Ҵ�Ϊ��ʼԭ�ϣ���ϼ�֪��Ϣѡ���Ҫ�����Լ���д�� �ĺϳ�·��____________________��(��֪��RCH=CHR��
�ĺϳ�·��____________________��(��֪��RCH=CHR��![]() RCOOH+R��COOH��R��R'Ϊ�������ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)
RCOOH+R��COOH��R��R'Ϊ�������ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ʵ��������Ũ�����������ϡ���ᣬ��д����Ӧ�Ļ�ѧ����ʽ���������ɡ�
(1)����SnCl2��Һʱ����SnCl2(s)����Ũ������ټ�ˮϡ��______��
(2)����MnO2��Ũ����Ļ������ȡ����______��
(3)����Ũ������Ũ������������ˮ�����ܽ��(����HAuCl4)______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com