
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,左图为其工作原理,右图为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是
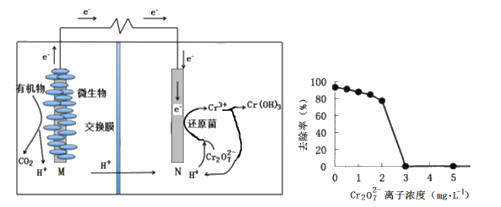
A. 有机物被氧化,M为电源负极
B. 电池工作时,N极附近溶液pH增大
C. Cr2O72-离子浓度较大时,可能会造成还原菌失活
D. 处理0.1 mol Cr2O72-时有1.4 mol H+从交换膜左侧向右侧迁移
【答案】D
【解析】
电解池装置图中H+向右移动,则N电极为正极,发生还原反应,Cr2O72-得电子生成Cr3+,M极失电子发生氧化反应,有机物被氧化生成CO2,为原电池的负极,以此解答该题。
A.由分析可知,M电极有机物失电子发生氧化反应,M为负极,故A正确;
B. 根据图示,正极反应为Cr2O72-+6e-+14H+=2Cr3++7H2O,消耗氢离子,N极附近溶液pH增大,故B正确;
C.Cr2O72-具有强氧化性,能使蛋白质变性,浓度较大时,可能会造成还原菌失活,故C正确;
D. Cr元素由+6价变为+3价, 处理0.l mol Cr2O72-时转移0.6mol电子,根据电荷守恒,处理0.1 mol Cr2O72-时有0.6 mol H+从交换膜左侧向右侧迁移,故D错误;选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )

A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锗被广泛用于制作高纯金属锗、锗化合物、化工催化剂及医药工业,某工厂用褐煤烟灰(主要成分C、GeO2,还有少量Al2O3和SiO2)为原料制备GeO2,其流程如下:

已知:GeO2难溶于水,不跟水反应,是以酸性为主的两性氧化物,溶于强碱溶液生成锗酸盐,与浓盐酸生成GeCl4(GeCl4的沸点是83.1℃)
(1)用水浸取焙烧物2小时的目的是____________________,操作“X”的名称为________,该操作除了冷凝管、铁架台、牛角管、锥形瓶、石棉网、酒精灯外还缺少的玻璃仪器是________
(2)写出焙烧时二氧化锗与氢氧化钠发生反应的化学方程式________________________________
(3)“酸化”至溶液中盐酸浓度为5.3 mol/L时有利于生成GeCl4,写出该反应的化学方程式:____若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是____________
(4)GeO2产品中通常混有少量SiO2。取样品w g,测得其中氧原子的物质的量为n mol,则该样品中GeO2的物质的量为____________mol(用含w、n的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些建筑材料含有放射性元素氡22286Rn,会对人体产生一定危害。研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟。该原子的中子数与质子数之和及之差分别是
A. 136,86B. 50,136
C. 222 , 50D. 222,86
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,并且可与X的氢化物形成一种共价化合物。Y的离子半径是同周期主族元素中最小的,Z原子最外层电子数是其内层电子数的3/5,下列说法中一定正确的是
A. W的氧化物对应水化物为强酸,具有强氧化性。
B. 简单离子半径:Y<W<X<Z
C. 简单氢化物沸点:Z<X
D. 工业上一般采取电解Y的熔融氯化物来生产Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。下列叙述正确的是( )

A. HA为弱酸,MOH为强碱
B. 水的电离程度:X>Y=Z
C. 若升高温度,Y、Z点对应溶液的pH均减小
D. 将Y点与Z点对应溶液以体积比为1:10混合,所得溶液中:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空
(1)标准状况下,密度为0.75g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为_________。
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是___;A的相对原子质量是______;ACl2的化学式是_________。
(3)已知agA和bgB恰好完全反应生成0.2molC和dgD,则C的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ______________。

(2)为防止氯气尾气污染空气,可用________溶液吸收多余的氯气,原理是(用化学方程式表示)____________________。
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_______(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_______(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是
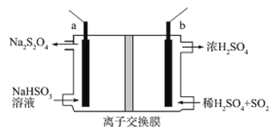
A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com