
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是
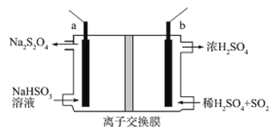
A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
【答案】D
【解析】A、由装置图中物质转化关系可知,左边由 NaHSO3得到电子转化为Na2S2O4,右边由SO2失去电子转化为H2SO4,所以a电极接电源的负极,b电极接电源的正极,故A错误;B、a电极的反应式为2HSO3-+2e-+2H+= S2O42-+2H2O,b电极的反应式为SO2+2H2O-2e-=SO42-+4H+,所以装置中离子交换膜为阳离子交换膜,则B错误;C、由电极反应式可知,每转移1mole-消耗SO2的0.5mol,但没有给气体的温度和压强,所以SO2气体的体积无法计算,故C错误;D、a电极的电极反应式为2HSO3-+2e-+2H+= S2O42-+2H2O,所以D正确。本题正确答案为D。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是()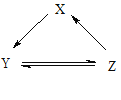
项目 | X | Y | Z |
A | Si | SiO2 | H2SiO3 |
B | Na | NaOH | NaCl |
C | NO | NO2 | HNO3 |
D | NaClO | HClO | Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下3种试剂:A.饱和食盐水 B.NaOH溶液 C.浓硫酸
请在以上试剂中选择填空:
①X、Y溶液分别应选用______(填“A”、“B”或“C”)、
②尾气处理过程中,多余的氯气可用______(填“A”、“B”或“C”)吸收。
(2)某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验。

①写出Cl2与水反应的离子方程式______。
②通入Cl2后,从集气瓶A、B的现象可得出的结论是______。
(3)如图所示,上述实验过程中,不会产生气体的是______,写出反应A的化学方程式______。

(4)碘是人体中不可缺少的微量元素,碘缺乏病是目前已知的导致人类智力障碍的主要原因,我国在食盐中加入碘元素能有效防止缺碘引起的疾病。

某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
甲.加入萃取剂后振荡乙.静置分层丙.分离
①该同学所采用的萃取剂可能是______(填“A”、“B”或“C”)。
A.酒精 B.苯C.四氯化碳
②甲、乙、丙3步实验操作中,不正确的是______(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )

A. Cu和浓硝酸 B. CaO和浓氨水
C. 大理石和稀盐酸 D. 高锰酸钾溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3和NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
Ⅰ.提供的装置


Ⅱ.NH3的制取
(1)下列有关实验室制备气体的说法正确的是________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤加热条件下,用浓盐酸洗涤高锰酸钾分解制氧气的试管
(2)从所提供的装置中选取一个能制取氨气的装置:______(填序号)。
(3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是______________________。
Ⅲ.模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:

(4)A中反应的离子方程式为____________________________________。
(5)装置D的作用有:使气体混合均匀、调节气流速度,还有一个作用是___________________________________。
(6)D装置中的液体可换成________(填序号)。
a.CuSO4 b.H2O c.CCl4 d.浓硫酸
(7)该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
(1)SO2(g)+2CO(g)2CO2(g)+S(l)△H<0
①如果要提高上述反应的反应速率,可以采取的措施是 . (选填编号)
a.减压 b.增加SO2的浓度 c.升温 d.及时移走产物
②若反应在恒容的密闭绝热容器中进行,下列说法不正确的是 . (选填编号)
a.平衡前,随着反应的进行,容器内压强始终不变
b.当容器内温度不再变化时,反应达到了平衡
c.其他条件不变,升高温度可增大平衡常数
d.其他条件不变,使用不同催化剂,该反应热效应不同
③该反应的平衡常数表达式是′;某温度下2L恒定容器中加入2mol的SO2和2mol的CO.10分钟内,气体密度减小了8g/L,则CO的反应速率是 .
(2)SO2(g)+NO2(g)NO(g)+SO3(g)
①在2L恒定容器中加入2mol的SO2和2mol的NO2 , 达到平衡时测得SO2的转化率为50%,向该容器中再加入1mol的SO2 , 平衡将向方向移动,计算重新达到平衡时SO2的浓度是 , SO2的转化率由50%变为 , NO2的转化率由变为 .
②实验结果启示我们:增大一种反应物浓度,其转化率将(填增大、减小或不变),另一种反应物的转化率将 . 现实生产的意义是:可以通过增大的用量,来提高成本高的反应物的利用率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1.B为常见液体.

试回答下列问题:
(1)X是______;F是______.
(2)A→D反应中每消耗1摩过氧化钠转移的电子数为______.
(3)G与Cu的反应中,G表现______性质.
(4)X与过量NaOH溶液反应的离子方程式:______.
(5)以C、B、D为原料可生产G,若使1molC完全转化为G,理论上至少需要D______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中△H的数值表示可燃物燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283 kJmol﹣1
O2(g)═CO2(g)△H=﹣283 kJmol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802.3 kJmol﹣1
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJmol﹣1
D.H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6 kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com