
【题目】如图中的每一方框内表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且A与C物质的量之比为1:1.B为常见液体.

试回答下列问题:
(1)X是______;F是______.
(2)A→D反应中每消耗1摩过氧化钠转移的电子数为______.
(3)G与Cu的反应中,G表现______性质.
(4)X与过量NaOH溶液反应的离子方程式:______.
(5)以C、B、D为原料可生产G,若使1molC完全转化为G,理论上至少需要D______mol.
【答案】 NH4HCO3 NO2 NA 酸性和氧化性 NH4++HCO3-+2OH-=2H2O+CO32-+NH3↑ 2
【解析】X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(氨气)与D(氧气)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G能与Cu反应生成NO、NO2,则G为HNO3,则
(1)由上述分析可知,X是NH4HCO3,F是NO2;(2)A→D反应为2CO2+2Na2O2=2Na2CO3+O2,消耗1mol过氧化钠转移的电子数为NA;(3)Cu与硝酸反应生成硝酸铜与氮的氧化物,反应中N元素的化合价部分为不变化,部分降低,故硝酸表现酸性、氧化性;(4)NH4HCO3与过量NaOH溶液反应的离子方程式为NH4++HCO3-+2OH-=2H2O+CO32-+NH3↑;(5)以NH3、H2O、O2为原料可生产HNO3,使1 molNH3完全转化为HNO3,根据电子转移守恒,理论上至少需要氧气的物质的量=1mol×[5(3)]÷4=2mol。


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( ) 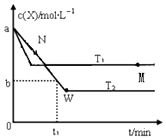
A.M点时再加入一定量的X,平衡后X的转化率增大
B.T2下,在0~t1时间内,v(Y)= ![]() mol/(L?min)
mol/(L?min)
C.M点的正反应速率v正小于N点的逆反应速率v逆
D.该反应进行到M点吸收的热量小于进行到W点放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是
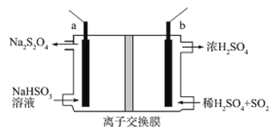
A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是_____________________________。
(2)有一铁的氧化物样品,用5mol/L盐酸140mL恰好完全溶解,所得溶液还能吸收标况下560mL氯气,Fe2+全部变成Fe3+,则该样品中Fe 和O 的个数比为_____________。
(3)某研究性学习小组用Fe2(SO4)3溶液腐蚀绝缘板上的铜,制造印刷电路板,为测定Fe2(SO4)3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则可检出待测液中含有的金属阳离子是_____;
②验证该溶液中含有Fe2+,正确的实验方法是__________(用字母代号填)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
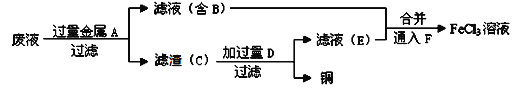
①滤渣C的主要成分的化学式为___________________________________。
②加过量D发生反应的离子方程为__________________________________。
③通入F发生反应的化学方程式为 __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素,它们在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:

(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式为_______________________,由此判断实验室保存C的水溶液应加入____________(填试剂名称),3molD与足量水蒸气高温下充分反应转移的电子数为_______。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为______________________。
(3)若C是一种能形成硫酸型酸雨的污染性气体,D是一种能支持燃烧和呼吸的气体,则反应③中氧化产物和还原产物的质量比为______________。
(4)若D是一种常见的温室气体,A、B、C的的焰色反应都呈黄色,现有120gB和C的混合物,充分加热后测得剩余固体质量为89g,则混合物中B的质量分数为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况}。向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是
A. 该合金中铜与铁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C. 得到2.54g沉淀时,加入NaOH溶液的体积是600mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下有四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
A.分别加水稀释10倍,四种溶液的pH①>②>④>③
B.①加入适量的氯化铵晶体后,溶液的pH减小
C.①溶液中c(NH4+)+c(H+)大于④中的c(Cl﹣)+c(OH﹣)
D.VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5 mol/L盐酸140 mL恰好完全溶解,所得溶液还能吸收标准状况下0.56 L氯气,使其中Fe2+全部转化为Fe3+。该样品可能的化学式是
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如右图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是

A. 氧气在石墨电极上发生氧化反应
B. 该电池的负极反应为Zn+H2O-2e-=ZnO+2H+
C. 该电池放电时OH-向石墨电极移动
D. 该电池充电时应将Zn电极与电源负极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com