
【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是()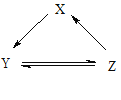
项目 | X | Y | Z |
A | Si | SiO2 | H2SiO3 |
B | Na | NaOH | NaCl |
C | NO | NO2 | HNO3 |
D | NaClO | HClO | Cl2 |
A. A B. B C. C D. D
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】有机物F 是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去).
请回答下列问题:
(1)B的结构简式是;E中含有的官能团名称是 .
(2)由C和E合成F的化学方程式是 .
(3)同时满足下列条件的苯的同分异构体的结构简式是
①含有3 个双键;②核磁共振氢谱只显示1 个吸收峰;③不存在甲基
(4)乙烯在实验室可由(填有机物名称)通过(填反应类型)制备,制乙烯时还产生少量SO2、CO2及水蒸气,用以下试剂检验这四种气体,混合气体通过试剂的顺序是(填序号);
①过量饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4⑤品红溶液.
(5)下列说法正确的是(填字母序号).
a..A 属于饱和烃b.D 与乙醛的分子式相同
c.E 不能与盐酸反应d.F 可以发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
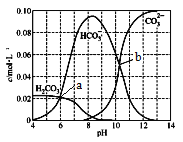
A. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
C. 25℃时,碳酸的第一步电离常数Ka1=10-6
D. 溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述错误的是
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 如图所示实验可证明元素的非金属性:Cl>C>Si
C. 若X-和Y2-的核外电子层结构相同,则原子序数:X>Y
D. 在周期表中金属与非金属分界处的锗是一种优良的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入l00g原粮,E中加入20.00mL l.50×l0-3 mol·L-1 KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。
回答下列问题:
(1)仪器D的名称是____________________________________。
(2)AlP与水反应的化学方程式为______________________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是__________________。
(4)通入空气的作用是_____________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为___________________________。
(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×l0-4 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:________________________________,则该原粮中磷化物(以PH3计)的含量为________________mg·kg-1(写计算表达式和计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关浓硫酸和浓硝酸的叙述错误的是
A. 浓H2SO4具有吸水性,因而可作干燥剂
B. 稀硝酸中可大量含有Cu2+、Fe2+、Cl-、SO![]()
C. 浓硝酸具有强氧化性,能使铝钝化,故常用铝罐车运输冷的浓硝酸
D. 向50mL18.4mol/LH2S04溶液中加入足量的铜片并加热,充分反应后,被还原的H2S04的物质的量小于0.46mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。

(1)可以鉴别甲和乙的试剂为__________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(2)上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是______(填名称),将其加入溴水中,振荡后静置,观察到的现象是______。
(3)以乙为主要原料合成乙酸,合成路线如图所示:(已知2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
![]()
①丁生成A的化学方程式为_______________;
②如图,丁与乙酸在浓硫酸作用下发生反应,当观察到b试管中有明显现象时,停止实验。生成的有机物的结构简式为___________;试管b中的溶液是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( ) 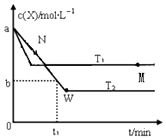
A.M点时再加入一定量的X,平衡后X的转化率增大
B.T2下,在0~t1时间内,v(Y)= ![]() mol/(L?min)
mol/(L?min)
C.M点的正反应速率v正小于N点的逆反应速率v逆
D.该反应进行到M点吸收的热量小于进行到W点放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是
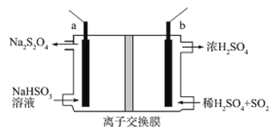
A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com