
【题目】下列有关浓硫酸和浓硝酸的叙述错误的是
A. 浓H2SO4具有吸水性,因而可作干燥剂
B. 稀硝酸中可大量含有Cu2+、Fe2+、Cl-、SO![]()
C. 浓硝酸具有强氧化性,能使铝钝化,故常用铝罐车运输冷的浓硝酸
D. 向50mL18.4mol/LH2S04溶液中加入足量的铜片并加热,充分反应后,被还原的H2S04的物质的量小于0.46mol
科目:高中化学 来源: 题型:
【题目】下列有关气体摩尔体积的描述中正确的是 ( )
A.一定温度和压强下,单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况下的气体摩尔体积约为22.4 L
C.标准状况下的气体摩尔体积约为22.4 L
D.标准状况下,1 mol O2的体积是22.4 L·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可用于制备常见的解热镇痛药阿司匹林.纯净的A为白色结晶性粉末,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 6.9g,升温使其汽化,测其密度是相同条件下CH4的8.625倍. | (1)A的相对分子质量为: . |
(2)将此6.9g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和15.4g | (2)A的分子式为: . |
(3)另取A 6.9g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况). | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱显示A有6种氢 | A的结构简式 |
(5)写出A与浓溴水反应的方程式: | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为18。下列叙述正确的是
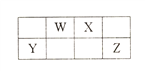
A. 氢化物的沸点:X<Z
B. 简单离子的半径:Y<X
C. 最高价氧化物对应水化物的酸性:Y>W
D. W与氢形成的所有化合物中的化学键均为极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是()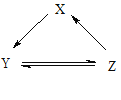
项目 | X | Y | Z |
A | Si | SiO2 | H2SiO3 |
B | Na | NaOH | NaCl |
C | NO | NO2 | HNO3 |
D | NaClO | HClO | Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.铁的摩尔质量就是铁的相对原子质量
B.SO42-的摩尔质量是96g/mol
C.1molO2的质量是32g/mol
D.CO2的摩尔质量是44g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据如下实验过程,回答相关问题:
![]()
(1)向A溶液中滴入几滴KSCN溶液后可观察到的现象是_______________________。
(2)写出反应①的化学方程式_________________________________。
写出反应②的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的通式可表示为:

单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质甲是金属,化合物A为烧碱,写出该反应的离子方程式:______________________
(2)若工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式______________
(3)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式 ________________________
(4)若化合物B为黑色磁性晶体,单质乙为气体,写出该反应的化学方程式___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
(1)SO2(g)+2CO(g)2CO2(g)+S(l)△H<0
①如果要提高上述反应的反应速率,可以采取的措施是 . (选填编号)
a.减压 b.增加SO2的浓度 c.升温 d.及时移走产物
②若反应在恒容的密闭绝热容器中进行,下列说法不正确的是 . (选填编号)
a.平衡前,随着反应的进行,容器内压强始终不变
b.当容器内温度不再变化时,反应达到了平衡
c.其他条件不变,升高温度可增大平衡常数
d.其他条件不变,使用不同催化剂,该反应热效应不同
③该反应的平衡常数表达式是′;某温度下2L恒定容器中加入2mol的SO2和2mol的CO.10分钟内,气体密度减小了8g/L,则CO的反应速率是 .
(2)SO2(g)+NO2(g)NO(g)+SO3(g)
①在2L恒定容器中加入2mol的SO2和2mol的NO2 , 达到平衡时测得SO2的转化率为50%,向该容器中再加入1mol的SO2 , 平衡将向方向移动,计算重新达到平衡时SO2的浓度是 , SO2的转化率由50%变为 , NO2的转化率由变为 .
②实验结果启示我们:增大一种反应物浓度,其转化率将(填增大、减小或不变),另一种反应物的转化率将 . 现实生产的意义是:可以通过增大的用量,来提高成本高的反应物的利用率.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com