
����Ŀ����ҵβ���еĵ������ﳣ�ð������շ���ԭ����NH3��NOx��Ӧ���������ʡ�ijͬѧ��������װ�úͲ���ģ�ҵ�ϵ�������Ĵ������̡�
��.�ṩ��װ��


��.NH3����ȡ
��1�������й�ʵ�����Ʊ������˵����ȷ����________(�����)��
�ٿ������ű���ʳ��ˮ�ķ����ռ����������ó��ȵ�̿��ˮ������Ӧ��ȡ��������ʵ������������ʱ��Ҫ���ȣ���ʱ����Ҫ���ȡ�������ˮ�Ȼ��Ƹ��ﰱ�����ݼ��������£���Ũ����ϴ�Ӹ�����طֽ����������Թ�
��2�������ṩ��װ����ѡȡһ������ȡ������װ�ã�______(�����)��
��3������������ѡ�õ�װ����ȡ����ʱ����Ӧ��Ӧ�Ļ�ѧ����ʽ��______________________��
��.ģ��β���Ĵ���
ѡ����������װ�ã�������˳�����ӳ�ģ��β������װ�ã��ش��й����⣺

��4��A�з�Ӧ�����ӷ���ʽΪ____________________________________��
��5��װ��D�������У�ʹ�����Ͼ��ȡ����������ٶȣ�����һ��������___________________________________��
��6��Dװ���е�Һ��ɻ���________(�����)��
a��CuSO4 b��H2O c��CCl4 d��Ũ����
��7����ͬѧ����Ƶ�ģ��β������ʵ�黹���ڵ�����ȱ����________________________________________________________________��
���𰸡� �٢ۢ� C(��G) 2NH4Cl��Ca(OH)2![]() 2NH3����CaCl2��2H2O��NH3��H2O��CaO===Ca(OH)2��NH3��(��Ӧ����) 3Cu��2NO
2NH3����CaCl2��2H2O��NH3��H2O��CaO===Ca(OH)2��NH3��(��Ӧ����) 3Cu��2NO![]() ��8H��===3Cu2����2NO����4H2O ��ֹ����NH3���ܽ���������� c NOβ��ֱ���ŷ���û�н��д���
��8H��===3Cu2����2NO����4H2O ��ֹ����NH3���ܽ���������� c NOβ��ֱ���ŷ���û�н��д���
����������1�������������ڱ���ʳ��ˮ��ʵ�����Ʊ�Cl2�������ű���ʳ��ˮ�������ռ����ʢ���ȷ�������ȵ�̿��ˮ������Ӧ����һ����̼����������ȡ�����������������������ӣ�ʵ����ͨ��ʹ��п��ϡ���ᷴӦ��ȡ����������������ʵ������������ʱ��Ҫ���ȣ���ʱ����Ҫ���ȣ��ø�����ء��������ȡ����ʱ��Ҫ���ȣ���˫��ˮ�ֽ�����������Ҫ���ȣ�������ȷ�����������Ȼ��Ʒ�����Ӧ������ʹ����ˮ�Ȼ��Ƹ��ﰱ���������ü�ʯ�Ҹ��ﰱ���������������ֽ��������������������Թ��ڱ��ϵĺ�ɫ�����Ƕ������̣����������ܺ�Ũ���ᷴӦ������Ũ����ϴ�ӷֽ������طֽ����������Թܣ�������ȷ����ѡ�٢ۢ���
��2�������������ƺ��Ȼ�粒�����Ի�ð���������ѡ��װ��C��������ʱ��������Ũ��ˮ�������ƹ����ð�������ѡ��װ��C��G����Ϊ��C��G��
��3�����ѡ��װ��C����Ӧ�ķ���ʽΪ��2NH4Cl+Ca(OH)2![]() 2NH3��+CaCl2+2H2O����ѡ��װ��G����Ӧ�ķ���ʽΪ��NH3��H2O+CaO=Ca(OH)2+NH3������Ϊ��2NH4Cl+Ca(OH)2
2NH3��+CaCl2+2H2O����ѡ��װ��G����Ӧ�ķ���ʽΪ��NH3��H2O+CaO=Ca(OH)2+NH3������Ϊ��2NH4Cl+Ca(OH)2![]() 2NH3��+CaCl2+2H2O��NH3��H2O+CaO=Ca(OH)2+NH3����
2NH3��+CaCl2+2H2O��NH3��H2O+CaO=Ca(OH)2+NH3����
��4��ϡ�������ǿ�����ԣ���ͭ����������ԭ��Ӧ��������ͭ��NO�ȣ���Ӧ�����ӷ���ʽΪ3Cu+8H++2NO3-=3Cu2++2NO��+4H2O����Ϊ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
��5��Dװ��ʹ�����Ͼ��ȡ����������ٶȣ����⣬���������ڱ��Ͱ�ˮ���ɷ�ֹ��������Ϊ����ֹ����NH3���ܽ������������
��6����������������ͭ��Һ��ˮ�Լ������У��ɲ�������������Ϊ���Է��ӣ������ڷǼ����ܼ�������CCl4���汥�Ͱ�ˮ����Ϊ��c
��7��ȱ��β������װ�ã�������NOβ��ֱ���ŷţ�����Ⱦ��������Ϊ��NOβ��ֱ���ŷţ�û�н��д�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������AlP��ͨ������Ϊһ�ֹ�����Ѭ��ɱ�������ˮ������������߶���PH3���壨�е�-89.7�棬��ԭ��ǿ����ij��ѧ��ȤС���ͬѧ�����������ⶨ��ʳ�в�������ĺ�����

��C�м���l00gԭ����E�м���20.00mL l.50��l0-3 mol��L-1 KMnO4��Һ��H2SO4�ữ������C�м�������ˮ����ַ�Ӧ�����������Ʊ���Һ�ζ�E�й�����KMnO4��Һ��
�ش��������⣺
��1������D��������____________________________________��
��2��AlP��ˮ��Ӧ�Ļ�ѧ����ʽΪ______________________________________________��
��3��װ��A��ʢװKMnO4��Һ�������dz�ȥ�����еĻ�ԭ�����壬װ��B��ʢ�н���ûʳ����ļ�����Һ����������__________________��
��4��ͨ�������������_____________________________��
��5��װ��E��PH3�����������ᣬ��װ��E�з�����Ӧ���������ͻ�ԭ�����ʵ���֮��Ϊ___________________________��
��6���ռ�װ��E�е�����Һ����ˮϡ����250mL��ȡ25.00mL����ƿ�У���4.0��l0-4 mol��L-1��Na2SO3����Һ�ζ�ʣ���KMnO4��Һ������Na2SO3����Һ15.00mL��Na2SO3��KMnO4��Һ��Ӧ�����ӷ���ʽΪ��________________________________�����ԭ���������PH3�ƣ��ĺ���Ϊ________________mg��kg-1��д�������ʽ�ͼ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L���ܱ������У�����1molX��g����2molY��g��������Ӧ��X��g��+m Y��g��3Z��g����ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ��g�����㶨�¶������£���ƽ���X��Y��Z������������䣮����������ȷ���ǣ� ��
A.�ڶ���ƽ��ʱ��Z��Ũ��Ϊ0.2 molL��1
B.m=3
C.X��Y��ƽ��ת����֮��Ϊ1��2
D.����Z��ƽ��û�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ǻ�ѧ�г��õ�˼ά����������������ȷ���ǣ� ��
A. CO2��ֱ���ͷ��ӣ��Ʋ�CS2Ҳ��ֱ���ͷ���
B. SiH4�ķе����CH4���Ʋ�H2S�ķе����H2O
C. Fe��Cl2��Ӧ����FeCl3���Ʋ�Fe��I2��Ӧ����FeI3
D. NaCl��ŨH2SO4���ȿ���HCl���Ʋ�NaBr��ŨH2SO4���ȿ���HBr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������H2��ԭWO3�Ʊ�����W��װ����ͼ��ʾ��Zn������������������ʣ�����ûʳ������Һ������������������������˵����ȷ����

A. �١��ڡ���������ʢװKMnO4��Һ��ŨH2SO4������ûʳ������Һ
B. ��ʽ¯����ǰ�����Թ��ڢܴ��ռ����岢��ȼ��ͨ�������ж����崿��
C. ������Ӧʱ���ȹرջ���K����ֹͣ����
D. װ��Q�����շ�������Ҳ�����ڶ���������Ũ���ᷴӦ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(Na2S2O4)�׳Ʊ��շۣ���һ��ǿ��ԭ������ҵ���ö��Ե缫������������Ƶķ����Ʊ������������ƣ�ԭ��װ����ͼ��ʾ������˵����ȷ����
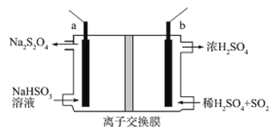
A. b�缫Ӧ�ýӵ�Դ�ĸ���
B. װ�����������ӽ���ĤΪ�����ӽ���Ĥ
C. ��·��ÿת��1mole-����SO2�����Ϊ11.2L
D. a�缫�ĵ缫��ӦʽΪ��2HSO3-+2e-+2H+=S2O42-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ұ������ԭ����������(��Ҫ�ɷ���Al2O3������ΪFe2O3��SiO2��)��ij�о�С����Ƶ��ᴿAl2O3�ķ���������

��1������a�г�����ɳ�⣬һ������____��������Һa������a�IJ�����Ҫ�IJ�������Ϊ__________________��
��2����Һa�к���Ԫ�ص�����������Լ�A��Ӧ�����ӷ���ʽΪ_______________����Һa������Լ�A��Ӧ��������b�����ӷ���ʽΪ__________________��
��3����Һb������Լ�B��Ӧ��������c�����ӷ���ʽΪ_______________________��
��4����������c�õ��������IJ�����Ҫʹ�õ��������˾ƾ��ơ����Ǽܡ������ǣ�����________������Ҫ�������ƣ���ʵ�����ﻹ����NaAlO2��Һ��ͨ�������_______����ȡA1(OH)3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����ѧ��ѧ�ij������ʣ�����A��B��C������ͬһ��Ԫ�أ�������һ���������ת���Ĺ�ϵ����ͼ��ʾ�����ַ�Ӧ�е�H2O����ȥ��������գ�

��1����A����������ˮ������D�����������������������;���Ľ������ʣ���Ӧ�ڵ����ӷ���ʽΪ_______________________���ɴ��ж�ʵ���ұ���C��ˮ��ҺӦ����____________�����Լ����ƣ���3molD������ˮ���������³�ַ�Ӧת�Ƶĵ�����Ϊ_______��
��2����A��һ�ּ������壬�������������B������β��֮һ�����������ɫ����Ӧ�ٵĻ�ѧ����ʽΪ______________________��
��3����C��һ�����γ��������������Ⱦ�����壬D��һ����֧��ȼ�պͺ��������壬��Ӧ������������ͻ�ԭ�����������Ϊ______________��
��4����D��һ�ֳ������������壬A��B��C�ĵ���ɫ��Ӧ���ʻ�ɫ������120gB��C�Ļ�����ּ��Ⱥ���ʣ���������Ϊ89g����������B����������Ϊ_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ���ƿ�У���25��ʱ��������ƽ�⣺2NO2��g��N2O4��g����H��0������ƿ����100���ˮ�У������м��������в���ı���ǣ� ��
����ɫ ��ƽ����Է������� ������ ��ѹǿ ���ܶȣ�
A.�ٺ͢�
B.�ۺ͢�
C.�ܺ͢�
D.�ں͢�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com