
【题目】厦钨股份公司拟生产用于汽车贮氢的钨合金,此合金( )
A.熔点比钨高B.不能导电C.具有金属特性D.是一种不可回收物
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。

(1)可以鉴别甲和乙的试剂为__________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(2)上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是______(填名称),将其加入溴水中,振荡后静置,观察到的现象是______。
(3)以乙为主要原料合成乙酸,合成路线如图所示:(已知2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
![]()
①丁生成A的化学方程式为_______________;
②如图,丁与乙酸在浓硫酸作用下发生反应,当观察到b试管中有明显现象时,停止实验。生成的有机物的结构简式为___________;试管b中的溶液是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是( )
A. CO2是直线型分子,推测CS2也是直线型分子
B. SiH4的沸点高于CH4,推测H2S的沸点高于H2O
C. Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D. NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是
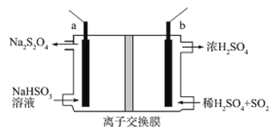
A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)滤渣a中除含泥沙外,一定含有____,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是_____________________________。
(2)有一铁的氧化物样品,用5mol/L盐酸140mL恰好完全溶解,所得溶液还能吸收标况下560mL氯气,Fe2+全部变成Fe3+,则该样品中Fe 和O 的个数比为_____________。
(3)某研究性学习小组用Fe2(SO4)3溶液腐蚀绝缘板上的铜,制造印刷电路板,为测定Fe2(SO4)3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则可检出待测液中含有的金属阳离子是_____;
②验证该溶液中含有Fe2+,正确的实验方法是__________(用字母代号填)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
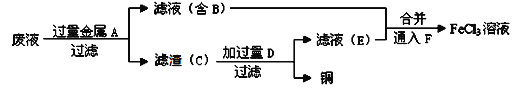
①滤渣C的主要成分的化学式为___________________________________。
②加过量D发生反应的离子方程为__________________________________。
③通入F发生反应的化学方程式为 __________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素,它们在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空:

(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,则反应②的离子方程式为_______________________,由此判断实验室保存C的水溶液应加入____________(填试剂名称),3molD与足量水蒸气高温下充分反应转移的电子数为_______。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为______________________。
(3)若C是一种能形成硫酸型酸雨的污染性气体,D是一种能支持燃烧和呼吸的气体,则反应③中氧化产物和还原产物的质量比为______________。
(4)若D是一种常见的温室气体,A、B、C的的焰色反应都呈黄色,现有120gB和C的混合物,充分加热后测得剩余固体质量为89g,则混合物中B的质量分数为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下有四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
A.分别加水稀释10倍,四种溶液的pH①>②>④>③
B.①加入适量的氯化铵晶体后,溶液的pH减小
C.①溶液中c(NH4+)+c(H+)大于④中的c(Cl﹣)+c(OH﹣)
D.VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.含金属元素的离子一定都是阳离子
B.金属阳离子被还原不一定得到金属单质
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属原子失电子越多,其还原性越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com