
【题目】下列有关物质用途的说法中,不正确的是
A.75%的乙醇溶液作医用消毒剂B.Fe3O4用作红色油漆和涂料
C.ClO2可用作自来水消毒剂D.Na2O2用作呼吸面具等的供氧剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】综合利用CO2对环境保护及能开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______________。
a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是__________________________。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O![]() CO+H2+O2,已知:
CO+H2+O2,已知:
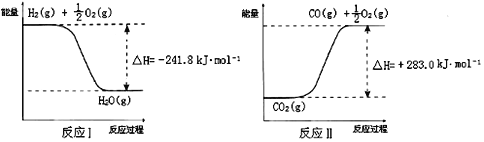
反应A的热化学方程式是___________________________。用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________.
2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________.

(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

① 电极b发生______________(填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。下列叙述正确的是( )

A. HA为弱酸,MOH为强碱
B. 水的电离程度:X>Y=Z
C. 若升高温度,Y、Z点对应溶液的pH均减小
D. 将Y点与Z点对应溶液以体积比为1:10混合,所得溶液中:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应HX(g)![]() 1/2H2(g)+ 1/2X2(g) 的平衡常数为0.1。若将等物质的量的H2(g)和X2(g)通入体积为1L的密闭容器中,在该温度下HX(g)的最大产率接近于( )
1/2H2(g)+ 1/2X2(g) 的平衡常数为0.1。若将等物质的量的H2(g)和X2(g)通入体积为1L的密闭容器中,在该温度下HX(g)的最大产率接近于( )
A. 83% B. 17% C. 5% D. 33%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 ______________。

(2)为防止氯气尾气污染空气,可用________溶液吸收多余的氯气,原理是(用化学方程式表示)____________________。
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_______(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是_______(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置分别进行下列各组物质的导电性实验,小灯泡的亮度比反应前明显减弱的是

A. 向亚硫酸钠溶液中通入氯气
B. 向硝酸银溶液中通入少量氯化氢
C. 向氢碘酸饱和溶液中通入少量氧气
D. 向氢氧化钠溶液中通入少量氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________。
(2)X、Y、Z、W四种元素中,电负性最大的是_________(填元素符号,下同);同周期元素中,第一电高能介于Y和Z之间的有__________________。
(3)Y和W的氯化物熔点高的是______(填化学式),原因是_____________________;与Z的低价氯化物互为等电子体的离子是_______(填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的杂化类型有___________________。

(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____个WX,说明在形成晶体时,半径大的粒子先进行了_______方式的堆积,晶胞中距离W最近的X有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室由间苯二酚合成2-硝基-1,3-苯二酚的原理如下:

已知:
物质 | 间苯二酚 | 2-硝基-1,3-苯二酚 |
熔点 | 109~112℃ | 84.85℃ |
沸点 | 276.5℃ | 234℃ |
溶解性 | 易溶于水 | 微溶于水 |
相对分子质量 | 110 | 155 |
实验药品:间苯二酚、浓硫酸(98%)、混合酸(由浓硝酸和浓硫酸按2:3的体积比混合而成)、尿素等。
实验步骤:
Ⅰ.称取2.7g间苯二酚粉末,放入100mL锥形瓶中,再加入13mL浓硫酸,同时充分搅拌,反应放热,立即生成白色磺化物。
Ⅱ.当反应物冷却后,用滴管滴加预先用冰水浴冷却好的混合酸,同时进行搅拌,并使反应温度不超过30℃.将生成的黄色粘稠状液体在室温下放置15min,再用7.5mL带有碎冰的冷水稀释,保持温度在50℃以下,得到红褐色的稠状液体。
Ⅲ.将反应液转移至250mL烧瓶中(如右下图所示,夹持和加热装置均已略去),再加入0.1g尿素,进行蒸馏,蒸馏液通过抽滤,洗涤干燥后,可得到橘红色片状晶体粗品。

试回答下列问题:
(1)进行产物蒸馏时,冷却水应从______(填“a”或“b”)口进入。
(2)实验过程中,温度控制在较低温度下进行的原因可能是:______。
(3)实验过程中配制混酸的正确操作是:______。
(4)加入尿素,其目的是使多余的硝酸和尿素反应而被除去。其中反应之一的化学方程式为:2CO(NH2)2+6HNO3=NH4NO3+8NO↑+2CO2↑+5H2O,若生成1.12LCO2(标准状况下)时,则转移的电子数为______。
(5)对粗品进行(方法)可提高产品纯度。若干燥后称量所得产品的质量为 2.1g,则其产率为______(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com