
【题目】综合利用CO2对环境保护及能开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______________。
a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是__________________________。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O![]() CO+H2+O2,已知:
CO+H2+O2,已知:
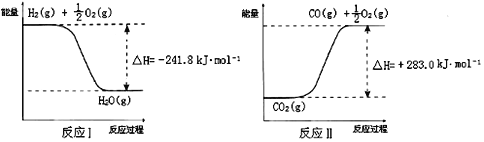
反应A的热化学方程式是___________________________。用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________.
2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________.

(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

① 电极b发生______________(填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是___________________________。
【答案】a、b CO2 + Li4SiO4 ![]() Li2CO3 + Li2SiO3 CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1 吸热 4×10﹣6 氧化 CO2 + 2e- = CO + O2-
Li2CO3 + Li2SiO3 CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1 吸热 4×10﹣6 氧化 CO2 + 2e- = CO + O2-
【解析】
(1)二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2与氧化性无关,据此解题;
(2)在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐,该盐为Li2SiO3,据此书写反应原理方程式;
(3)根据图示反应Ⅰ和反应Ⅱ书写热化学反应方程式,构造目标方程式利用盖斯定律解答;
(4)根据表中温度对生产气体的浓度的影响分析;根据表中数据结合平衡常数的表达式求出反应NH2COONH4(s)2NH3(g)+CO2(g)的平衡常数;
(5)电极b氧离子失去电子发生氧化反应生成氧气;二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;
(1)a. Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a项正确;
b. Li2O、Na2O、MgO均能吸收CO2,钠、镁为ⅠA、ⅡA族元素,所以可在ⅠA和ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b项正确;
c. Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c项错误;
故答案为:a、b;
(2)在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4![]() Li2CO3+Li2SiO3,
Li2CO3+Li2SiO3,
故答案为:CO2+Li4SiO4![]() Li2CO3+Li2SiO3;
Li2CO3+Li2SiO3;
(3)根据图像可知,反应I的热化学方程式可表示为:H2(g) + ![]() O2(g) = H2O(g) ΔH = -241.8 kJ·mol-1 ①,同理可得反应II的热化学方程式可表示为:CO2(g) = CO(g) +
O2(g) = H2O(g) ΔH = -241.8 kJ·mol-1 ①,同理可得反应II的热化学方程式可表示为:CO2(g) = CO(g) +![]() O2(g) ΔH = +283.0 kJ·mol-1 ②,则根据盖斯定律可知, ②-①得CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g),其反应热ΔH = +283.0 kJ·mol-1-(-241.8 kJ·mol-1)= +524.8 kJ·mol-1,则反应A的热化学方程式为:CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1,
O2(g) ΔH = +283.0 kJ·mol-1 ②,则根据盖斯定律可知, ②-①得CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g),其反应热ΔH = +283.0 kJ·mol-1-(-241.8 kJ·mol-1)= +524.8 kJ·mol-1,则反应A的热化学方程式为:CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1,
故答案为:CO2(g) + H2O(g) = CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1;
(4)从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应;从反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)可知,氨气与二氧化碳按物质的量之比为2:1生成,表中显示在15℃、t2时达到平衡,气体总浓度为3×102 mol/L,则c(NH3) = 3×102 mol/L×
2NH3(g)+CO2(g)可知,氨气与二氧化碳按物质的量之比为2:1生成,表中显示在15℃、t2时达到平衡,气体总浓度为3×102 mol/L,则c(NH3) = 3×102 mol/L×![]() = 2×102 mol/L,c(CO2) = 3×102 mol/L×
= 2×102 mol/L,c(CO2) = 3×102 mol/L×![]() = 1×102 mol/L,所以K=c2(NH3)×c(CO2) = (2×102 mol/L)2×1×102 mol/L = 4×106,
= 1×102 mol/L,所以K=c2(NH3)×c(CO2) = (2×102 mol/L)2×1×102 mol/L = 4×106,
故答案为:吸热;4×106;
(5)①CO2+H2O![]() CO+H2+O2,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应在电极b附近生成氧气,即电极b发生氧化反应;
CO+H2+O2,反应物中的氧元素化合价升高,被氧化,失去电子发生氧化反应在电极b附近生成氧气,即电极b发生氧化反应;
故答案为:氧化;
②二氧化碳在a极得到电子,发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为CO2+2e-═CO+O2-,
故答案为:CO2+2e-═CO+O2-。


科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+![]() Fe2++Cr3+。下列说法正确的是
Fe2++Cr3+。下列说法正确的是

A. 电池充电时,b极的电极反应式为Cr3++e-=Cr2+
B. 电池充电时,Cl-从a极穿过选择性透过膜移向b极
C. 电池放电时,a极的电极反应式为Fe3++3e-=Fe
D. 电池放电时,电路中每通过0. 1 mol电子,Fe3+浓度降低0. 1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
则下列叙述错误的是( )
A. A气体是NH3,B气体是CO2
B. 把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C. 纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D. 第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合物的水溶液,只可能含以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、 NH4+、Cl-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:① 第一份加入AgNO3溶液有沉淀产生,② 第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲,③ 在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g,④ 第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。根据上述实验回答:
(1)一定不存在的离子是____________________,不能确定是否存在的离子是________________
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):离子符号____________,浓度____________________
(3)试确定K+ 是否存在________ (填“是”或“否”),判断的理由是:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。


(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应Al2O3+N2+3C ![]() 2AlN+3CO的叙述正确的是
2AlN+3CO的叙述正确的是
A. Al2O3是氧化剂,C是还原剂 B. 每生成1 mol CO需转移2 mol电子
C. AlN中氮元素的化合价为+3 D. N2发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种缩醛类香料。具体合成路线如图(部分反应条件略去):

已知以下信息:
①![]()
②D为能与金属钠反应的芳香族化合物
回答下列问题:
⑴A的名称是_________,图中缩醛的分子式是_________。
⑵B的结构简式为_______。
⑶以下有关C的说法正确的是_________。
a.易溶于水 b.分子中所有原子可能在同一平面
c.与乙醇互为同系物 d.在一定条件下能发生消去反应生成乙炔
⑷③、⑤的有机反应类型依次为为______、______,④的化学方程式为_____________。
⑸写出满足下列条件的苯乙醛的所有同分异构体的结构简式:含有苯环,加入FeCl3溶液显紫色,核磁共振氢谱有5组峰,峰面积之比为2∶2∶2∶1∶1。 ________________
⑹参照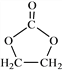 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备 的合成路线(注明必要的反应条件)。_________________________________
的合成路线(注明必要的反应条件)。_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2S溶于水的电离方程式为H2S![]() 2H++S2-,向H2S溶液中加入少量CuCl2固体,电离平衡正向移动
2H++S2-,向H2S溶液中加入少量CuCl2固体,电离平衡正向移动
B. KHSO4在熔融状态下的电离方程式为KHSO4 = K++H++SO42-,向醋酸中加入少量KHSO4固体,电离平衡逆向移动
C. 向稀氨水中滴加少量2mol/LNH4NO3,溶液,NH4+与OH- 结合生成NH3·H2O,使平衡正向移动,电离常数增大
D. 常温下,冰醋酸加水稀释的过程中,溶液的导电能力先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是
A.75%的乙醇溶液作医用消毒剂B.Fe3O4用作红色油漆和涂料
C.ClO2可用作自来水消毒剂D.Na2O2用作呼吸面具等的供氧剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com