
【题目】有一混合物的水溶液,只可能含以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、 NH4+、Cl-、CO32-、SO42-,现取三份100 mL溶液进行如下实验:① 第一份加入AgNO3溶液有沉淀产生,② 第二份加过量NaOH溶液加热后收集到气体0.02 mol,无沉淀生成,同时得到溶液甲,③ 在甲溶液中通过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g,④ 第三份加足量BaCl2溶液后得白色沉淀,沉淀经足量盐酸洗涤干燥后质量为11.65 g。根据上述实验回答:
(1)一定不存在的离子是____________________,不能确定是否存在的离子是________________
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):离子符号____________,浓度____________________
(3)试确定K+ 是否存在________ (填“是”或“否”),判断的理由是:____________
【答案】Fe3+、Mg2+、CO32—、Ba2+ Cl— SO42— 0.5mol/L 是 溶液中肯定存在的离子是NH4+、Al3+、SO42—。经计算NH4+、Al3+物质的量都是0.02mol,SO42—物质的量是0.05mol,根据电荷守恒,K+一定存在
【解析】
①第一份加入几滴AgNO3溶液后有沉淀产生,溶液中可能含有Cl﹣、CO32﹣、SO42﹣;
②第二份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,该气体是氨气,一定有铵根离子,铵根离子的物质的量是0.02mol,无沉淀生成,一定不含Fe3+、Mg2+;③在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g,说明原溶液中一定存在Al3+,结合离子共存可知一定不存在CO32﹣;1.02g为氧化铝的质量,其物质的量为:![]() =0.01mol,说明每份溶液中含有0.02molAl3+;
=0.01mol,说明每份溶液中含有0.02molAl3+;
④第三份加足量BaCl2溶液后,得白色沉淀,该白色沉淀为硫酸钡,说明原溶液中一定存在SO42﹣,则一定不存在钡离子;沉淀经足量盐酸洗涤、干燥后,质量为11.65g,则硫酸钡的物质的量为:![]() =0.05mol,说明每份溶液中含有0.05molSO42﹣;0.02molAl3+所带正电荷为0.06mol、0.02mol铵根离子带有0.02mol正电荷,而0.05molSO42﹣所带负电荷为0.1mol,根据电荷守恒可知,说明溶液中一定还含有阳离子K+。
=0.05mol,说明每份溶液中含有0.05molSO42﹣;0.02molAl3+所带正电荷为0.06mol、0.02mol铵根离子带有0.02mol正电荷,而0.05molSO42﹣所带负电荷为0.1mol,根据电荷守恒可知,说明溶液中一定还含有阳离子K+。
(1)根据分析可知,一定存在的离子为:K+、NH4+、Al3+、SO42﹣,一定不存在的离子为:Fe3+、Mg2+、CO32﹣、Ba2+,根据分析可知,无法确定是否存在Cl﹣,所以溶液中可能存在Cl﹣;
故答案为:Fe3+、Mg2+、CO32﹣、Ba2+;Cl﹣;
(2)铵根离子的物质的量是0.02mol,含有0.02molAl3+,含有0.05molSO42﹣,0.02molAl3+所带正电荷为0.06mol、0.02mol铵根离子带有0.02mol正电荷,而0.05molSO42﹣所带负电荷为0.1mol,根据电荷守恒可知,说明溶液中一定还含有阳离子K+,溶液体积为0.1L,所以其浓度分别为0.2mol/L、0.2mol/L、0.5mol/L,
故答案为:SO42﹣、0.5mol/L;
(3) 溶液中肯定存在的离子是NH4+、Al3+、SO42—,经计算NH4+、Al3+物质的量都是0.02mol,SO42—物质的量是0.05mol,根据电荷守恒,K+一定存在。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A. ①②③B. ①③④C. ①③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下①6.72L CH4②3.01×1023个HCl分子③13.6g H2S④0.2mol NH3,体积最大的是____,密最大的是度___,质量最小的是___,氢原子个数最多的是____。(填写序号)
(2)等温等压下,质子数相等的CO、N2两种气体,质量之比为____,体积之比为____,摩尔质量之比____。
(3)某物质在一定条件下加热分解,产物都是气体。分解方程式为:3A=B+3C+2D。测得生成的混合气体的平均相对分子质量为2a,则A的摩尔质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
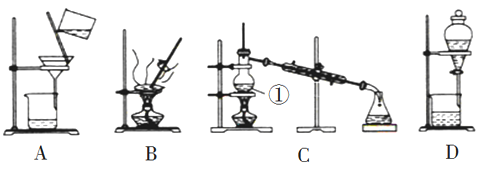
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是__________装置B中玻璃棒不断搅拌,其作用是_________
(2)从氯化钠溶液中得到氯化钠固体,选择装置__________(填代表装置图的字母)。
(3)装置C中①的名称是__________,①中加入沸石的作用是_________,冷却水的方向是_____________________
(4)已知:在常温下,苯(C6H6)为一种无色、透明的液体,密度为 0.8786 g/cm3, 毒性较高,易挥发,易燃,有腐蚀性,沸点为 80.1℃,难溶于水,易溶于有机溶剂,可作为有机溶剂;碘(I2)为紫黑色晶体,易升华,易凝华,熔点 113.5℃,沸点 184.3℃,加热时碘升华为紫色蒸气,冷却后凝华成紫黑色固体.实验室常用苯来提取碘水中的碘,然后分液,最后蒸馏碘的苯溶液,得到单质碘。 其中采用装置C蒸馏碘的苯溶液时常用水浴加热装置C中仪器①,你认为不直接加热的原因是_______;同时锥形瓶置于盛有冰水的烧杯中,你认为其目的是________
(5)海带中含有丰富的碘,为了从海带中提取碘,第一步是灼烧海带,此操作除需要三脚架外,还需要用到下列的实验仪器是____________
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.镊子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2对环境保护及能开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______________。
a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是__________________________。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O![]() CO+H2+O2,已知:
CO+H2+O2,已知:
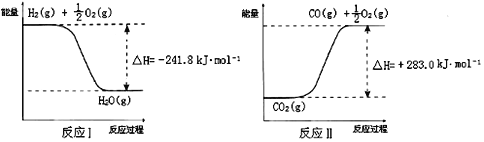
反应A的热化学方程式是___________________________。用稀氨水喷雾捕集CO2最终可得产品NH4HCO3.在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成.现将一定量纯净的氨基甲酸铵置于恒容的密闭真空容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________.
2NH3(g)+CO2(g).实验测得的有关数据见上表.( t1<t2<t3)氨基甲酸铵分解反应是________反应(“放热”、“吸热”).在15℃,此反应的化学平衡常数为:__________.

(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

① 电极b发生______________(填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下图中序号①~④仪器的名称:

①___________;②___________; ③___________; ④___________。
(2)仪器①~④中,使用时必须检查是否漏水的有__________(填仪器序号)。
(3)右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol·L-l的稀硫酸。

可供选用的仪器有: ①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
①配制稀硫酸时,还缺少的仪器有__________、__________(写仪器名称)。
②经计算,配制480 mL l mol·L-l的稀硫酸需要用量筒量取上述浓硫酸的体积为________mL。将量取好的浓硫酸缓慢注入到盛水的烧杯后,发现量筒里还残留有浓硫酸,如果用蒸馏水洗涤后一并将洗涤液注入烧杯,将使结果浓度______(填“偏高”“偏低”或“无影响”)。
③在转入容量瓶前烧杯中液体应_______,否则会使结果浓度____(填“偏高”“偏低”或“无影响”)。
④定容时必须使溶液的凹液面与刻度线相平,若俯视会使浓度______。(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应HX(g)![]() 1/2H2(g)+ 1/2X2(g) 的平衡常数为0.1。若将等物质的量的H2(g)和X2(g)通入体积为1L的密闭容器中,在该温度下HX(g)的最大产率接近于( )
1/2H2(g)+ 1/2X2(g) 的平衡常数为0.1。若将等物质的量的H2(g)和X2(g)通入体积为1L的密闭容器中,在该温度下HX(g)的最大产率接近于( )
A. 83% B. 17% C. 5% D. 33%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com