
����Ŀ����1��д����ͼ��������������������ƣ�

��___________����___________�� ��___________�� ��___________��
��2�������������У�ʹ��ʱ�������Ƿ�©ˮ����__________����������ţ���
��3����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص�Ũ�����Լ���ǩ�ϵIJ������ݡ����ø�Ũ��������480 mL 1 mol��L��l��ϡ���ᡣ

�ɹ�ѡ�õ������У� ����ͷ�ιܣ�����ƿ�����ձ�����ҩ�ף�����Ͳ����������ƽ��
��ش��������⣺
������ϡ����ʱ����ȱ�ٵ�������__________��__________��д�������ƣ���
�������㣬����480 mL l mol��L��l��ϡ������Ҫ����Ͳ��ȡ����Ũ��������Ϊ________mL������ȡ�õ�Ũ���Ỻ��ע�뵽ʢˮ���ձ�������Ͳ�ﻹ������Ũ���ᣬ���������ˮϴ�Ӻ�һ����ϴ��Һע���ձ�����ʹ���Ũ��______������ƫ������ƫ����������Ӱ��������
����ת������ƿǰ�ձ���Һ��Ӧ_______�������ʹ���Ũ��____������ƫ������ƫ����������Ӱ��������
������ʱ����ʹ��Һ�İ�Һ����̶�����ƽ�������ӻ�ʹŨ��______��������ƫ������ƫ����������Ӱ��������
���𰸡� Բ����ƿ ������ ��Һ©�� 100ml����ƿ �ۢ� 500ml����ƿ ������ 27.2 ƫ�� �ָ����� ƫ�� ƫ��
�������������������1������ͼʾд�١�����������������2������ĥ�ڲ�����������ʹ��ʱ�������Ƿ�©ˮ����3���� ��������һ�����ʵ���Ũ�ȵ���Һ���������Ҫ��������������480 mL l mol��L��l��ϡ��������Ҫ500mL����ƿ������ϡ��ǰ���������ʵ������������ҪŨ�������������������ˮϴ����Ͳ��һ����ϴ��Һע���ձ�����ʹ�������ʵ���ƫ��Ũ��������ˮ���ȣ���ֱ��ת������ƿ���������Һ���ƫС���� ����ʱ�����ӿ̶���ʹ��Һ���ƫС��
��������1������ͼʾ�١������������Ʒֱ���Բ����ƿ������������Һ©����100ml����ƿ����2������ĥ�ڲ�����������ʹ��ʱ�������Ƿ�©ˮ��������������������Ҫ�����Ƿ�©ˮ�з�Һ©����100ml����ƿ����3��������һ�����ʵ���Ũ�ȵ���Һ�����У����㡢��ȡ��ϡ�Ͳ���ȴ�����¡���Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ���棬������Ҫ�������н�ͷ�ι����ձ�����Ͳ��500ml����ƿ����������������![]() ,����������98%���ܶ�Ϊ1.84g/cm3��Ũ���ᣬ���ʵ���Ũ����
,����������98%���ܶ�Ϊ1.84g/cm3��Ũ���ᣬ���ʵ���Ũ����![]() ������480 mL l mol��L��l��ϡ��������Ҫ500mL����ƿ������ϡ��ǰ���������ʵ���������
������480 mL l mol��L��l��ϡ��������Ҫ500mL����ƿ������ϡ��ǰ���������ʵ��������� ![]() ��
�� ![]() ��v=0.0272L��������Ҫȡ����Ũ��������Ϊ27.2mL�����������ˮϴ����Ͳ��һ����ϴ��Һע���ձ�����ʹ�������ʵ���ƫ����ҺŨ��ƫ�ߣ���Ũ��������ˮ���ȣ���ֱ��ת������ƿ���������Һ���ƫС����ҺŨ��ƫ�ߣ�������ת������ƿǰ�ձ���Һ��Ӧ��ȴ���������� ����ʱ�����ӿ̶���ʹ��Һ���ƫС����ҺŨ��ƫ����
��v=0.0272L��������Ҫȡ����Ũ��������Ϊ27.2mL�����������ˮϴ����Ͳ��һ����ϴ��Һע���ձ�����ʹ�������ʵ���ƫ����ҺŨ��ƫ�ߣ���Ũ��������ˮ���ȣ���ֱ��ת������ƿ���������Һ���ƫС����ҺŨ��ƫ�ߣ�������ת������ƿǰ�ձ���Һ��Ӧ��ȴ���������� ����ʱ�����ӿ̶���ʹ��Һ���ƫС����ҺŨ��ƫ����


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һЩ���ʻ�����Ĵ�����ϵ����ȷ����

X | Y | Z | |
A | �������� | ���������� | ������ |
B | ���� | ������ | ����� |
C | ������Һ | ���� | ��ɢϵ |
D | �û���Ӧ | ������ԭ��Ӧ | ���ӷ�Ӧ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������ˮ��Һ��ֻ���ܺ����������е������֣�K+��Al3+��Fe3+��Mg2+��Ba2+�� NH4+��Cl����CO32����SO42������ȡ����100 mL��Һ��������ʵ�飺�� ��һ�ݼ���AgNO3��Һ�г�������,�� �ڶ��ݼӹ���NaOH��Һ���Ⱥ��ռ�������0.02 mol���������ɣ�ͬʱ�õ���Һ��,�� �ڼ���Һ��ͨ����CO2�����ɰ�ɫ���������������ˡ�ϴ�ӡ����գ�����Ϊ1.02 g,�� �����ݼ�����BaCl2��Һ��ð�ɫ��������������������ϴ�Ӹ��������Ϊ11.65 g����������ʵ��ش�
��1��һ�������ڵ�������____________________������ȷ���Ƿ���ڵ�������________________
��2����ȷ����Һ�п϶����ڵ������Ӽ���Ũ��(�ɲ�����)�����ӷ���____________��Ũ��____________________
��3����ȷ��K+ �Ƿ����________ (��ǡ���)���жϵ������ǣ�____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Է�ӦAl2O3��N2��3C ![]() 2AlN��3CO��������ȷ����
2AlN��3CO��������ȷ����
A. Al2O3����������C�ǻ�ԭ�� B. ÿ����1 mol CO��ת��2 mol����
C. AlN�е�Ԫ�صĻ��ϼ�Ϊ��3 D. N2������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��5���л���ѧ����]A(C2H4)�ǻ������л�����ԭ�ϡ���A�ͳ������л���ɺϳ�һ����ȩ�����ϡ�����ϳ�·����ͼ�����ַ�Ӧ������ȥ����

��֪������Ϣ��
��![]()
��DΪ��������Ʒ�Ӧ�ķ����廯����
�ش��������⣺
��A��������_________��ͼ����ȩ�ķ���ʽ��_________��
��B�Ľṹ��ʽΪ_______��
�������й�C��˵����ȷ����_________��
a��������ˮ b.����������ԭ�ӿ�����ͬһƽ��
c.���Ҵ���Ϊͬϵ�� d.��һ���������ܷ�����ȥ��Ӧ������Ȳ
�Ȣ��������л���Ӧ��������ΪΪ______��______�����Ļ�ѧ����ʽΪ_____________��
��д���������������ı���ȩ������ͬ���칹��Ľṹ��ʽ�����б���������FeCl3��Һ����ɫ���˴Ź���������5��壬�����֮��Ϊ2��2��2��1��1�� ________________
������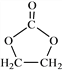 �ĺϳ�·�ߣ����һ����2���ȱ���ͱ�Ҫ�����Լ��Ʊ�
�ĺϳ�·�ߣ����һ����2���ȱ���ͱ�Ҫ�����Լ��Ʊ� �ĺϳ�·�ߣ�ע����Ҫ�ķ�Ӧ��������_________________________________
�ĺϳ�·�ߣ�ע����Ҫ�ķ�Ӧ��������_________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڣ�ʵ������Ӻ�������ȡ��Ĺ������£�
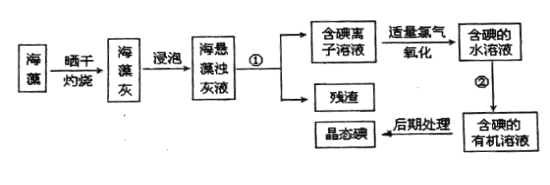
����д���пհף�
��1�����պ���ʱ������Ҫ���ż�.�������⣬����Ҫ�õ���ʵ��������________________����������������ѡ��������������ñ����ĸ��д�ڿհ״�����
A.�ձ� B.������ C.������ D.������ E.�ƾ��� F.����ǯ
��2��ָ����ȡ��Ĺ������йص�ʵ��������ƣ���________����________
��3����ȡ��Ĺ��̢��У�ͨ����________________���������ƣ��н��У����õ����Ǻ�������Ȼ�̼��Һ�����ú�ֲ㣬�²�Ϊ________________ɫ��
��4�����������������ӷ���ʽ��ʾ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. H2S����ˮ�ĵ��뷽��ʽΪH2S![]() 2H++S2-����H2S��Һ�м�������CuCl2���壬����ƽ�������ƶ�
2H++S2-����H2S��Һ�м�������CuCl2���壬����ƽ�������ƶ�
B. KHSO4������״̬�µĵ��뷽��ʽΪKHSO4 = K++H++SO42-��������м�������KHSO4���壬����ƽ�������ƶ�
C. ��ϡ��ˮ�еμ�����2mol/LNH4NO3,��Һ��NH4+��OH- �������NH3��H2O��ʹƽ�������ƶ������볣������
D. �����£��������ˮϡ�͵Ĺ����У���Һ�ĵ���������������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHSO4��ˮ�еĵ��뷽��ʽΪNaHSO4![]() Na++H++SO42����ij�¶���,��c(H+)=1��10-6 mol��L-1������ˮ�м���NaHSO4����,�����¶Ȳ���,�����Һ��c(H+)=1��10-2 mol��L-1�����жԸ���Һ����������ȷ����
Na++H++SO42����ij�¶���,��c(H+)=1��10-6 mol��L-1������ˮ�м���NaHSO4����,�����¶Ȳ���,�����Һ��c(H+)=1��10-2 mol��L-1�����жԸ���Һ����������ȷ����
A. ���¶ȸ���25 ��
B. ��ˮ���������H+��Ũ��Ϊ1��10-10 mol��L-1
C. ����NaHSO4���������ˮ�ĵ���
D. ȡ����Һ��ˮϡ��100��,��Һ�е�c(OH-)��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com