
【题目】有一种有机物的键线式酷似牛,被称为牛式二烯炔醇(如图)。下列有关该化合物的说法不正确的是
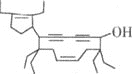
A.该分子中含有三种官能团
B.该物质能与金属钠反应产生氢气
C.该分子中甲基上的一氯代物有6种
D.1mol该物质最多可与![]() 发生加成反应
发生加成反应
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
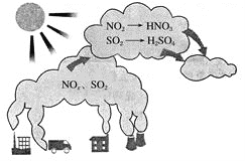
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量的关系如图所示。
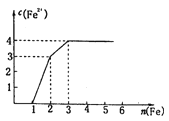
溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1:1:1B.1:3:1C.1:1:4D.3:3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:
反应 | 热化学方程式 | 平衡常数 |
① | 2CO2(g)+6H2(g) | K1 |
② | CO(g)+H2O(g) | K2 |
③ | 2CO(g)+4H2(g) | K3 |
则ΔH1=___________(用ΔH2、ΔH3表示);K3=____________(用K1、K2表示)。
(2)针对反应①研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
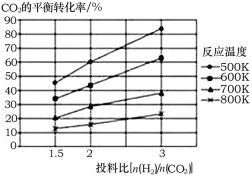
①ΔH1______(填写“>”或“<”)0;
②若其他条件不变,仅仅增大压强, 则逆反应速率____________(填“增大”、“减小”或“不变”,下同),平衡常数K____________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是______________;

②若在2 L恒容密闭容器中,将3 mol CO、1 molSO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________;
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是____(填序号)。
A.CO B.SO2 C.N2 D.H2S E.CO2
(4)一定温度下,向某体积不变的密闭容器中通入一定量的CO(g)和H2O(g)发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(
CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(![]() )、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
)、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
A. 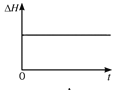 B.
B. 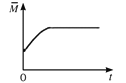 C.
C. 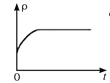 D.
D. 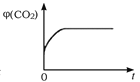
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上用焦炭与SiO2反应可制得粗硅,反应的化学方程式为__,该反应中有元素化合价升高的物质是__,(填化学式,下同),氧化剂是___。
(2)由粗硅制纯硅过程如下:Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯),请写出上述过程中有关反应的化学方程式__,__。
Si(纯),请写出上述过程中有关反应的化学方程式__,__。
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0gSiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L,生成氢气的离子方程式为__,硅酸盐的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大短周期元素,A的最外层电子数是其电子层数2倍;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于其它电子层上的电子数之和。
(1)A元素名称为______,D在周期表中的位置________,离子半径大小B___C(填“>”“<”或“=”)。
(2)B的两种单质在常温下都是气体,它们互为____________。比较B的氢化物和D的氢化物沸点:B___D(填“>”“<”或“=”),原因是_________________。
(3)E中含有化学键类型:_________,属于___________化合物(填“离子化合物”或“共价化合物”)。
(4)用电子式表示C与D的二元化合物的形成过程:_____________________。
(5)氢原子与B分别形成10电子和18电子分子,写出18电子分子转化成10电子分子的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
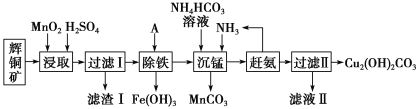
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_________,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为_________mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:_________________________。
(5)“赶氨”时,最适宜的操作方法是________________。
(6)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(已知硅与稀硫酸不反应),测定通常状况(20℃,101 kPa)下的气体摩尔体积。拟选用下列实验装置完成实验:

(1)该小组同学必须选用的装置依次连接的合理顺序为A、_____________。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,开始时稀硫酸能滴人锥形瓶中,一段时间后稀硫酸不能顺利滴入锥形瓶中,其原因是____________________。
(3)金属铝与稀硫酸反应的离子方程式为_________________。
(4)实验结束时,测量实验中生成H2体积的操作方法是_______________。
(5)实验中准确测得3个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验后量筒中液面读数为V ml。。则通常状况下气体摩尔体积Vm=__________L·mol-l。若合金中含少量铜,则所测得的Vm将____________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com