
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:
反应 | 热化学方程式 | 平衡常数 |
① | 2CO2(g)+6H2(g) | K1 |
② | CO(g)+H2O(g) | K2 |
③ | 2CO(g)+4H2(g) | K3 |
则ΔH1=___________(用ΔH2、ΔH3表示);K3=____________(用K1、K2表示)。
(2)针对反应①研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
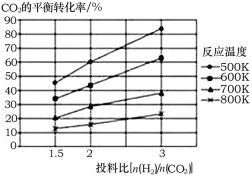
①ΔH1______(填写“>”或“<”)0;
②若其他条件不变,仅仅增大压强, 则逆反应速率____________(填“增大”、“减小”或“不变”,下同),平衡常数K____________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是______________;

②若在2 L恒容密闭容器中,将3 mol CO、1 molSO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________;
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是____(填序号)。
A.CO B.SO2 C.N2 D.H2S E.CO2
(4)一定温度下,向某体积不变的密闭容器中通入一定量的CO(g)和H2O(g)发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(
CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(![]() )、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
)、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
A. 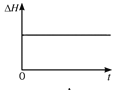 B.
B. 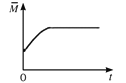 C.
C. 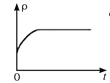 D.
D. 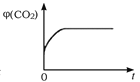
【答案】ΔH3-2ΔH2 K1K22 < 增大 不变 在相对较低的温度下可获得较高的SO2转化率,从而节约能源 0.44 A D
【解析】
(1)根据盖斯定律可知:反应①=反应③-2×反应②,可求ΔH1,K3;
(2)①观察图象,随温度升高,CO2的平衡转化率逐渐减小,结合平衡移动原理可知该反应为吸热还是放热反应;
②结合反应速率、平衡常数的影响因素回答即可;
(3)①条件的选择关键在于在使用较低成本,较少时间,而能够达到较高转化率;
②已知起始量3 mol CO、1molSO2,SO2的平衡转化率为40%,代入三段式即可求出各物质平衡量,即可求出K;
③结合平衡移动影响因素选择恰当的物质;
(4)可逆反应达到平衡状态时,各物质浓度、物质的量、百分含量等数据不再变化,特别注意混合气体平均相对分子质量等相关物理量的计算。
(1)根据盖斯定律可知:反应①=反应③-2×反应②,则ΔH1=ΔH3-2ΔH2,K3=K1×K22;
答案为:ΔH3-2ΔH2;K1K22;
(2)①由图可知,升高温度,CO2的平衡转化率降低,则正反应为放热反应,ΔH1<0,
答案为:<;
②增大压强,正逆反应速率均增大,K只与温度有关,平衡常数K不变;
答案为:增大;不变;
(3)①选择Fe2O3作催化剂,原因是在相对较低的温度下可获得较高的SO2转化率,从而节约能源;
答案为:在相对较低的温度下可获得较高的SO2转化率,从而节约能源;
②将3 mol CO、1molSO2,因为SO2的平衡转化率为40%,则△n(SO2)=1 mol×40%=0.4mol,将数据代入三段式: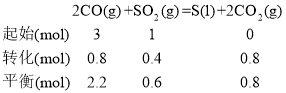 因为容积为2L,则平衡时c(CO)=1.1mol/L,c(SO2)=0.3mol/L,c(CO2)=0.4mol/L, 则
因为容积为2L,则平衡时c(CO)=1.1mol/L,c(SO2)=0.3mol/L,c(CO2)=0.4mol/L, 则![]() ;
;
答案为:0.44;
③增加CO浓度,可以使平衡正向移动,进而使SO2转化率增大;
答案为:A;
(4)A. 焓变指可逆反应完全反应的能量变化,与平衡移动无关,故A错;
B. 对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),由于气体总质量与气体总物质的量在任意时刻均不变,则混合气体平均相对分子质量为定值,故B错;
CO2(g)+H2(g),由于气体总质量与气体总物质的量在任意时刻均不变,则混合气体平均相对分子质量为定值,故B错;
C. 对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),由于气体总质量与容器体积不变,则气体密度为定值,故C错;
CO2(g)+H2(g),由于气体总质量与容器体积不变,则气体密度为定值,故C错;
D. CO2体积分数平衡前一直改变,平衡后不再变化,可以说明达到平衡状态,故D正确;
答案为:D。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关.下列说法不正确的是( )
A.石油裂解可获得乙烯,可从煤干馏得到的煤焦油中提取苯
B.衣服中的棉、麻成分都属于纤维素
C.用纯碱制玻璃,用铁矿石炼铁都会产生温室气体![]()
D.地沟油和矿物油的主要化学成分相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质。下列说法正确的是
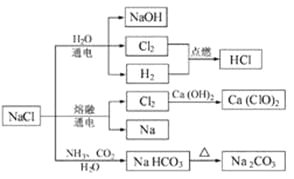
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
C.图4所示转化反应都是氧化还原反应
D.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2![]() N2O4)。
N2O4)。
(1)硝酸在该反应中体现的性质有__________________。
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式_________________________。
(3)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________mL;所得溶液(假设溶质不扩散)的物质的量浓度是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不是氧化还原反应的是
A. 3Cl2+6KOH===5KCl+KClO3+3H2O
B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D. 2AgNO3+BaCl2===2AgCl↓+Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种有机物的键线式酷似牛,被称为牛式二烯炔醇(如图)。下列有关该化合物的说法不正确的是
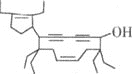
A.该分子中含有三种官能团
B.该物质能与金属钠反应产生氢气
C.该分子中甲基上的一氯代物有6种
D.1mol该物质最多可与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备高纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题。
(1)第①步制备粗硅的化学反应方程式为___。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点31.8℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为__。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置已略去)。

①装置B中的试剂是__,装置C中的烧瓶需要加热,其目的是__;
②反应一段时间后,装置D中观察到的现象是__,装置D不能采用普通玻璃管的原因是__,装置D中发生反应的化学方程式为__;
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___;
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是___(填字母)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() ,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( )
,为研究影响该反应速率的因素,在不同条件下进行4组实验,Y、Z的起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。下列说法不正确的是( )

A.若实验②、④只改变一个条件,则由实验②、④得出结论:升高温度,化学反应速率加快
B.若实验①、②只改变一个条件,则由实验①、②得出结论:增大反应物浓度,化学反应速率加快
C.若实验②、③只改变一个条件,则实验③使用了催化剂
D.0~10min内,实验③的平均速率v(Y)=0.04 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的
的![]() 溶液中
溶液中![]() 的浓度为
的浓度为![]() ,请回答下列问题:
,请回答下列问题:
(1)下列物质能导电的是__________,属于电解质的是__________,属于非电解质的是__________,(填序号)
①氯化钠晶体 ②氨气 ③水银 ④蔗糖 ⑤石墨 ⑥熔融![]() ⑦空气 ⑧BaSO4 ⑨稀盐酸
⑦空气 ⑧BaSO4 ⑨稀盐酸
(2)写出![]() 在水溶解中的电离方程式:_________________;写出NaHSO4在熔融状态下的电离方程式:_______________________________。
在水溶解中的电离方程式:_________________;写出NaHSO4在熔融状态下的电离方程式:_______________________________。
(3)![]() 溶液与NaHCO3溶液混合有气泡生成,反应的离子方程式_______________
溶液与NaHCO3溶液混合有气泡生成,反应的离子方程式_______________
(4)①若![]() 与
与![]() 溶液混合后溶液显中性,请写出反应的离子方程式_________________________________________________________________。
溶液混合后溶液显中性,请写出反应的离子方程式_________________________________________________________________。
②若![]() 与
与![]() 溶液中混合溶液呈碱性,请写出反应的离子方程式___________________________________________________。
溶液中混合溶液呈碱性,请写出反应的离子方程式___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com