
【题目】晶体硅是一种重要的非金属材料,制备高纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题。
(1)第①步制备粗硅的化学反应方程式为___。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点31.8℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为__。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置已略去)。

①装置B中的试剂是__,装置C中的烧瓶需要加热,其目的是__;
②反应一段时间后,装置D中观察到的现象是__,装置D不能采用普通玻璃管的原因是__,装置D中发生反应的化学方程式为__;
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___;
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是___(填字母)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
【答案】SiO2+2C![]() Si+2CO↑ 分馏(或蒸馏) 浓硫酸 使滴入烧瓶中的SiHCl3汽化 石英管的内壁附有灰黑色晶体 在该反应温度下,普通玻璃管会软化 SiHCl3+H2
Si+2CO↑ 分馏(或蒸馏) 浓硫酸 使滴入烧瓶中的SiHCl3汽化 石英管的内壁附有灰黑色晶体 在该反应温度下,普通玻璃管会软化 SiHCl3+H2![]() Si+3HCl 排尽装置内的空气 bd
Si+3HCl 排尽装置内的空气 bd
【解析】
(1)高温下,碳和二氧化硅反应生成硅和一氧化碳;
(2)利用沸点的不同提纯SiHCl3,可用蒸馏的方法;
(3)①生成的氢气含有水蒸气,用浓H2SO4干燥;加热促使SiHCl3气化;
②SiHCl3和氢气反应有硅单质生成,根据硅的颜色判断D装置中的现象;SiHCl3和H2反应生成硅和氯化氢;
③氢气是可燃性气体,易产生爆炸,SiHCl3在空气中易自燃,所以先通一段时间H2,将装置中的空气排尽;
④取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若溶液呈红色说明含Fe,若不呈红色说明不含Fe。
(1)高温下,碳做还原剂时,生成CO,制粗硅的化学方程式为SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(2)利用沸点的不同提纯SiHCl3,可用分馏(或蒸馏)的方法;
(3)①锌和稀硫酸反应制得的氢气中含有水蒸气,而SiHCl3能与水剧烈反应,所以实验中应使用干燥的氢气,一般选用浓H2SO4干燥氢气;加热的目的是使SiHCl3汽化,进入装置D中;
②高温下,SiHCl3和氢气反应生成硅单质,硅单质是灰黑色固体,所以D装置中的现象是:石英管的内壁附有灰黑色晶体,SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,化学方程式为SiHCl3+H2![]() Si+3HCl;装置D不能采用普通玻璃管的原因是:温度太高,普通玻璃管易熔化;
Si+3HCl;装置D不能采用普通玻璃管的原因是:温度太高,普通玻璃管易熔化;
③氢气是可燃性气体,当氢气的量达到一定时易产生爆炸,SiHCl3在空气中易自燃,所以实验的关键是检查装置的气密性、控制好温度,以及先通一段时间H2将装置中的空气排尽;
④铁能和稀盐酸反应生成亚铁离子,亚铁离子有还原性,亚铁离子能被氯水氧化生成铁离子,铁离子遇硫氰化钾溶液变红色,所以可以用氯水和硫氰化钾溶液检验铁的存在,故选bd。


科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述错误的是( )
A.在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
B.异丙苯( ![]() )的一氯代物有5种
)的一氯代物有5种
C.用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体
D.检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热,观察是否出现砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马兜铃酸是一种致癌物。如图为马兜铃酸的结构简式,R,R1,R2代表-H,-OH或-OCH3中的一种或几种,下列有关说法正确的是

A. 若R代表—OH,R1,R2代表—H,则对应有机物的分子式为C16H9NO7
B. 若R代表—H,R1,R2代表—OCH3,则对应有机物的结构中含有4种官能团
C. 若R,R1,R2均代表—H,则对应有机物能发生取代反应,氧化反应和水解反应
D. 若R,R1,R2中至少有1个代表—H,则对应的有机物最多有9种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:
反应 | 热化学方程式 | 平衡常数 |
① | 2CO2(g)+6H2(g) | K1 |
② | CO(g)+H2O(g) | K2 |
③ | 2CO(g)+4H2(g) | K3 |
则ΔH1=___________(用ΔH2、ΔH3表示);K3=____________(用K1、K2表示)。
(2)针对反应①研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
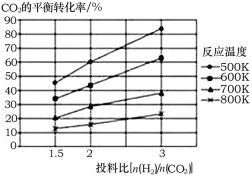
①ΔH1______(填写“>”或“<”)0;
②若其他条件不变,仅仅增大压强, 则逆反应速率____________(填“增大”、“减小”或“不变”,下同),平衡常数K____________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是______________;

②若在2 L恒容密闭容器中,将3 mol CO、1 molSO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________;
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是____(填序号)。
A.CO B.SO2 C.N2 D.H2S E.CO2
(4)一定温度下,向某体积不变的密闭容器中通入一定量的CO(g)和H2O(g)发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(
CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(![]() )、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
)、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
A. 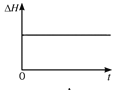 B.
B. 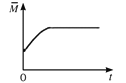 C.
C. 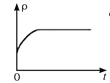 D.
D. 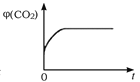
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律,判断下列语句,其中正确的组合是( )
①碱金属单质的熔点随原子序数的增大而降低
②砹(![]() )是第Ⅶ
)是第Ⅶ![]() 族,其氢化物的稳定性小于
族,其氢化物的稳定性小于![]()
③根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(![]() )与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥若X+和Y2﹣的核外电子层结构相同,则原子序数:X>Y
A.①③④B.①②⑥C.③④⑤D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大短周期元素,A的最外层电子数是其电子层数2倍;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于其它电子层上的电子数之和。
(1)A元素名称为______,D在周期表中的位置________,离子半径大小B___C(填“>”“<”或“=”)。
(2)B的两种单质在常温下都是气体,它们互为____________。比较B的氢化物和D的氢化物沸点:B___D(填“>”“<”或“=”),原因是_________________。
(3)E中含有化学键类型:_________,属于___________化合物(填“离子化合物”或“共价化合物”)。
(4)用电子式表示C与D的二元化合物的形成过程:_____________________。
(5)氢原子与B分别形成10电子和18电子分子,写出18电子分子转化成10电子分子的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种灰白色固体,能与水缓慢反应。利用NH3和Al在800℃以上反应可制备AlN,实验装置如下:

回答下列问题:
(1)装置②中盛放的药品为__________;装置④的作用是吸收氨气和__________。
(2)实验时先点燃①处酒精灯,其目的是______________________________________。
(3)为使实验安全,装置④的尾气处理方法是_____________________。
(4)装置①中发生反应的化学方程式为_____________________;装置③中发生反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是(__________)
A、纯铁硬度比生铁高
B、纯铁耐腐蚀性强,不易生锈
C、不锈钢是铁合金,只含金属元素
D、铁在一定条件下,可与水蒸气反应
E、铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为______,形成该分散系的微粒粒度范围是_______________。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出 FeCl3溶液与铜反应的离子方程式_____________。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水,需要用到的一组试剂是____________。
A、①②④ B、①③④⑥
C、②④⑤ D、①④⑥
(4)高铁酸钠Na2FeO4 是一种新型净水剂,能够杀菌消毒。高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com