
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2![]() N2O4)。
N2O4)。
(1)硝酸在该反应中体现的性质有__________________。
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式_________________________。
(3)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________mL;所得溶液(假设溶质不扩散)的物质的量浓度是______________________。
【答案】氧化性 酸性 3Cu + 10H++ 4NO3-= 3Cu2++NO↑+3NO2↑+5H2O 0.008NA 0.012mol 44.8mL 1/22.4mol·L-1(或0.0446 mol·L-1)
【解析】
(1)反应中氮元素化合价由+5价降低为+2、+4价,体现硝酸氧化性,同时生成硝酸盐,硝酸体现酸性;
(2)令铜为3mol,则HNO3为10mol,根据铜元素守恒可知,生成硝酸铜3mol,所以氧化剂作用的硝酸为10mol-6mol=4mol,令生成NO为xmol,则生成NO2为(4-x)mol,根据电子转移守恒可知,3x+(4-x)×1=3×2,解得x=1,即生成NO为1mol,则生成NO2为3mol,据此写出离子方程式;
(3)铜失去2个电子形成Cu2+,失去的电子物质的量是铜的2倍;根据电子转移守恒计算NO、NO2的物质的量,根据铜元素守恒计算硝酸铜的物质的量,根据氮元素守恒可知参加反应的硝酸的物质的量n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO);根据方程式4NO2+O2+2H2O=4HNO3、4NO+3O2+2H2O=4HNO3,计算需要通入O2的物质的量,生成硝酸的物质的量,根据V=cVm计算氧气体积,溶液体积等于一氧化氮与二氧化氮的体积之和,根据c= ![]() 计算硝酸浓度。
计算硝酸浓度。
(1)根据方程式,生成硝酸铜,所以硝酸体现酸性;有NO、NO2生成,氮元素化合价降低,所以硝酸表现氧化性;
(2)令铜为3mol,则HNO3为10mol,根据铜元素守恒可知,生成硝酸铜3mol,所以氧化剂作用的硝酸为10mol-6mol=4mol,令生成NO为xmol,则生成NO2为(4-x)mol,根据电子转移守恒可知,3x+(4-x)×1=3×2,解得x=1,即生成NO为1mol,则生成NO2为3mol,反应离子方程式为3Cu+10H++4NO3-=3Cu2++NO↑+3NO2↑+5H2O;
故答案为:3Cu+10H++4NO3-=3Cu2++NO↑+3NO2↑+5H2O;
(3)![]() ,0.004molCu被硝酸完全溶解后,Cu失去的电子数是0.008NA;根据得失电子守恒,设生成的NO的物质的量为xmol,
,0.004molCu被硝酸完全溶解后,Cu失去的电子数是0.008NA;根据得失电子守恒,设生成的NO的物质的量为xmol,![]() ,x=0.002mol;表现氧化性的硝酸0.004mol;表现酸性的硝酸0.004×2=0.008mol;参加反应的硝酸的物质的量是0.004mol+0.008mol=0.012mol;根据氧化还原反应的实质,据2Cu---O2可知,2:1=0.004:x=0.002mol,则通入O2的体积为44.8mL;所得溶液的物质的量浓度是
,x=0.002mol;表现氧化性的硝酸0.004mol;表现酸性的硝酸0.004×2=0.008mol;参加反应的硝酸的物质的量是0.004mol+0.008mol=0.012mol;根据氧化还原反应的实质,据2Cu---O2可知,2:1=0.004:x=0.002mol,则通入O2的体积为44.8mL;所得溶液的物质的量浓度是![]() =1/22.4mol·L-1。
=1/22.4mol·L-1。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.从海水中可以得到NaCl,电解NaCl溶液可以制备Na
C.从海水中提取溴的工艺流程中溴蒸气被吸收剂SO2吸收的目的是将海水中的溴富集
D.海水中提取镁所涉及的化学反应全部是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可分别通过如下两个反应制取氢气: ( )
a.CH3CH2OH(g)+H2O(g) ![]() 4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g) ![]() 6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
则下列说法正确的是( )
A.乙醇的燃烧热ΔH=-13.8 kJ·mol-1
B.升高反应a的反应温度,乙醇的转化率减小
C.2H2(g)+O2(g)=2H2O(g) ΔH=-229 kJ·mol-1
D.制取等量的氢气,反应b吸收的能量更少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量的关系如图所示。
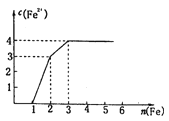
溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1:1:1B.1:3:1C.1:1:4D.3:3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马兜铃酸是一种致癌物。如图为马兜铃酸的结构简式,R,R1,R2代表-H,-OH或-OCH3中的一种或几种,下列有关说法正确的是

A. 若R代表—OH,R1,R2代表—H,则对应有机物的分子式为C16H9NO7
B. 若R代表—H,R1,R2代表—OCH3,则对应有机物的结构中含有4种官能团
C. 若R,R1,R2均代表—H,则对应有机物能发生取代反应,氧化反应和水解反应
D. 若R,R1,R2中至少有1个代表—H,则对应的有机物最多有9种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:
反应 | 热化学方程式 | 平衡常数 |
① | 2CO2(g)+6H2(g) | K1 |
② | CO(g)+H2O(g) | K2 |
③ | 2CO(g)+4H2(g) | K3 |
则ΔH1=___________(用ΔH2、ΔH3表示);K3=____________(用K1、K2表示)。
(2)针对反应①研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
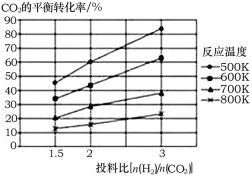
①ΔH1______(填写“>”或“<”)0;
②若其他条件不变,仅仅增大压强, 则逆反应速率____________(填“增大”、“减小”或“不变”,下同),平衡常数K____________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是______________;

②若在2 L恒容密闭容器中,将3 mol CO、1 molSO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________;
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是____(填序号)。
A.CO B.SO2 C.N2 D.H2S E.CO2
(4)一定温度下,向某体积不变的密闭容器中通入一定量的CO(g)和H2O(g)发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(
CO2(g)+H2(g),下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(![]() )、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
)、气体密度(ρ)、CO2体积分数φ(CO2)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是________(填序号)。
A.  B.
B.  C.
C. 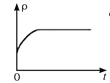 D.
D. 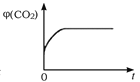
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大短周期元素,A的最外层电子数是其电子层数2倍;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于其它电子层上的电子数之和。
(1)A元素名称为______,D在周期表中的位置________,离子半径大小B___C(填“>”“<”或“=”)。
(2)B的两种单质在常温下都是气体,它们互为____________。比较B的氢化物和D的氢化物沸点:B___D(填“>”“<”或“=”),原因是_________________。
(3)E中含有化学键类型:_________,属于___________化合物(填“离子化合物”或“共价化合物”)。
(4)用电子式表示C与D的二元化合物的形成过程:_____________________。
(5)氢原子与B分别形成10电子和18电子分子,写出18电子分子转化成10电子分子的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.碳酸氢铵溶液与少量氢氧化钠溶液:![]()
B.氢氧化镁和盐酸反应:![]()
C.氨水与盐酸反应:![]()
D.碳酸钙溶于稀醋酸中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com