
【题目】下列说法正确的是
A.实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.从海水中可以得到NaCl,电解NaCl溶液可以制备Na
C.从海水中提取溴的工艺流程中溴蒸气被吸收剂SO2吸收的目的是将海水中的溴富集
D.海水中提取镁所涉及的化学反应全部是氧化还原反应
【答案】C
【解析】
A.碘以离子形式存在,需要加氧化剂氧化,则从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取,故A错误;
B.电解氯化钠溶液得到氢氧化钠、氢气和氯气,不能得到金属钠,工业上是电解熔融氯化钠得到,故B错误;
C.海水提溴过程中,将溴吹入吸收剂中吸收,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,故C正确;
D.从海水中提取镁涉及反应有:CaCO3![]() CaO+CO2↑、CaO+H2O═Ca(OH)2,MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;Mg(OH)2+2HCl=MgCl2+2H2O,MgCl26H2O
CaO+CO2↑、CaO+H2O═Ca(OH)2,MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;Mg(OH)2+2HCl=MgCl2+2H2O,MgCl26H2O![]() MgCl2+6H2O,MgCl2
MgCl2+6H2O,MgCl2![]() Mg+Cl2↑,只有电解氯化镁涉及氧化还原反应,故D错误。
Mg+Cl2↑,只有电解氯化镁涉及氧化还原反应,故D错误。
答案为C。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.30g乙酸和葡萄糖混合物中的氢原子数为2NA
B.标准状况下,22.4L的H2和22.4L的F2气混合后,气体分子数为2 NA
C.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12 NA
D.标准状况下,2.24LC2H6含有的共价键数为0.6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
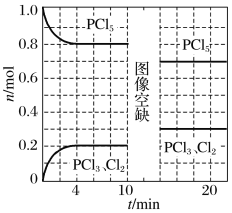
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由苯乙烯经下列反应可制得B、H两种高分子化合物,它们都是常用的塑料。
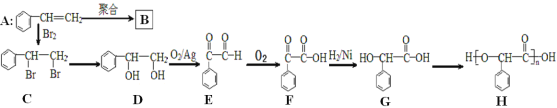
(1)G中所含官能团的名称为_____。
(2)聚合物B的结构简式是________;E的分子式是______________。
(3)C转化为D的化学方程式是_______________(应注明条件); F转化为G的反应类型属于______。
(4)写出G的一种符合下列条件的同分异构体X结简式_______________。
①X与FeCl3 溶液反应显色,也能发生银镜反应和水解反应,②X分子苯环上只有两个互为对位的取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A在标准状况下的密度为1.25 g·L-1,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:

(1)A的名称为________。
(2)E的结构简式_________________。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2~3次。该反应的化学方程式为________________________。

(4)以A为原料,在一定条件下,可以制备高分子化合物PE,该物质可用于保鲜膜、塑料食品袋、奶瓶、提桶、水壶等,请写出反应方程式_______,该反应属于_______(反应类型)。
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示,按图组装仪器,在试管1中先加入amLCH3CH2OH(密度为ρg/cm-3)和过量的冰醋酸(CH3CO18OH),并边振荡边缓缓加入2mL浓H2SO4,将试管固定在铁架台上,在试管2中加入适量的饱和Na2CO3溶液,用酒精灯对试管1加热,当观察到试管2中有明显现象时认为反应基本完成。

a.试管1中反应的化学方程式为__________________________________________。
b.当观察到试管2中有_____________________________现象时认为反应基本完成。
c.分离试管2中的混合物可以得到产品及回收未反应的乙酸和乙醇,实验操作流程如下:

操作②的名称是__________________。
d.最后得到纯净的乙酸乙酯bg,求本实验中乙酸乙酯的产率______(用a、b、ρ表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y 和 Z 三种元素的原子序数之和等于 42。X 元素原子的 4p 轨道上有 3 个未成对电子,Y 元素原子的最外层 2p 轨道上有 2 个未成对电子。X 与 Y 可形成化合物X2Y3 ,Z 元素可形成负一价离子。下列说法正确的是( )
A.X 元素基态原子的电子排布式为[Ar]4s2 4p3
B.X 元素是第 4 周期第 VA 族元素
C.Z 元素的单质在氧气中不能燃烧
D.Y 元素基态原子的轨道表示式为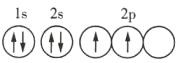
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关.下列说法不正确的是( )
A.石油裂解可获得乙烯,可从煤干馏得到的煤焦油中提取苯
B.衣服中的棉、麻成分都属于纤维素
C.用纯碱制玻璃,用铁矿石炼铁都会产生温室气体![]()
D.地沟油和矿物油的主要化学成分相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油通过分馏和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。如图是由乙烯为原料生产某些化工产品的转化关系图。
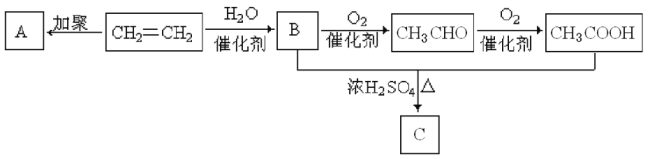
据此回答下列问题:
(1)写出乙烯的一种工业用途:__________,指出B+CH3COOH![]() C的反应类型:__________。
C的反应类型:__________。
(2)写出C的结构简式:__________。
(3)写出乙烯![]() A的化学反应方程式:__________。
A的化学反应方程式:__________。
(4)写出乙烯![]() B的化学反应方程式:__________。
B的化学反应方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑 2NO2![]() N2O4)。
N2O4)。
(1)硝酸在该反应中体现的性质有__________________。
(2)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式_________________________。
(3)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________mL;所得溶液(假设溶质不扩散)的物质的量浓度是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com