
【题目】石油通过分馏和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。如图是由乙烯为原料生产某些化工产品的转化关系图。
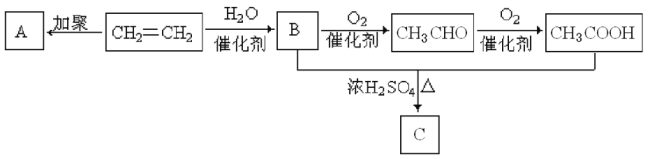
据此回答下列问题:
(1)写出乙烯的一种工业用途:__________,指出B+CH3COOH![]() C的反应类型:__________。
C的反应类型:__________。
(2)写出C的结构简式:__________。
(3)写出乙烯![]() A的化学反应方程式:__________。
A的化学反应方程式:__________。
(4)写出乙烯![]() B的化学反应方程式:__________。
B的化学反应方程式:__________。
【答案】生产聚乙烯塑料(或合成塑料) 酯化或取代反应 CH3COOC2H5 ![]() CH2=CH2+H2O
CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
【解析】
乙烯发生加聚反应生成A,A为![]() ,乙烯和水发生加成反应生成乙醇,则B为CH3CH2OH,乙醇被氧化生成CH3CHO,CH3CHO被氧化生成CH3COOH,乙醇和乙酸发生酯化反应生成乙酸乙酯,则C为CH3COOCH2CH3。
,乙烯和水发生加成反应生成乙醇,则B为CH3CH2OH,乙醇被氧化生成CH3CHO,CH3CHO被氧化生成CH3COOH,乙醇和乙酸发生酯化反应生成乙酸乙酯,则C为CH3COOCH2CH3。
(1)乙烯的一种工业用途:生产聚乙烯塑料(或合成塑料);在浓硫酸作催化剂、加热条件下,发生CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,乙醇和乙酸发生酯化反应生成乙酸乙酯。
CH3COOCH2CH3+H2O,乙醇和乙酸发生酯化反应生成乙酸乙酯。
故答案为:生产聚乙烯塑料(或合成塑料);酯化或取代反应;
(2)乙醇和乙酸发生酯化反应生成乙酸乙酯,则C为CH3COOCH2CH3。
故答案为:CH3COOCH2CH3;
(3)乙烯发生加聚反应生成A,A为![]() ,乙烯
,乙烯![]() A的化学反应方程式:
A的化学反应方程式:![]() 。
。
故答案为:![]() ;
;
(4)乙烯含有碳碳双键,乙烯可与水发生加成反应得到乙醇,乙烯![]() B的化学反应方程式:CH2=CH2+H2O
B的化学反应方程式:CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
故答案为:CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。


科目:高中化学 来源: 题型:
【题目】(1)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
①若130gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___。
②该反应中的氧化剂是___,氧化产物是___。
(2)O3能与KI溶液反应,生成一种能使带火星木条复燃的气体,向反应后溶液中滴入酚酞变为红色,若滴入淀粉溶液则变为蓝色。为测定大气中O3的含量,将0℃、1.01×105Pa、33.6m3的空气通入KI溶液,使之完全反应,再向所得溶液中滴加0.01mol/L的Na2S2O3溶液60mL恰好与之完全反应。(I2与Na2S2O3的反应式:2NaS2O3+I2=Na2S4O6+2NaI)
①写出并配平O3与KI溶液反应的化学方程式___;
②计算大气中O3的体积分数(即O3的体积与空气体积的比值,用科学记数法表示)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.从海水中可以得到NaCl,电解NaCl溶液可以制备Na
C.从海水中提取溴的工艺流程中溴蒸气被吸收剂SO2吸收的目的是将海水中的溴富集
D.海水中提取镁所涉及的化学反应全部是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
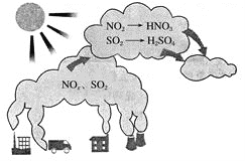
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述错误的是( )
A.在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
B.异丙苯( ![]() )的一氯代物有5种
)的一氯代物有5种
C.用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体
D.检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热,观察是否出现砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可分别通过如下两个反应制取氢气: ( )
a.CH3CH2OH(g)+H2O(g) ![]() 4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
4H2(g)+2CO(g) ΔH=+256.6 kJ·mol-1
b.2CH3CH2OH(g)+O2(g) ![]() 6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
6H2(g)+4CO(g) ΔH=+27.6 kJ·mol-1
则下列说法正确的是( )
A.乙醇的燃烧热ΔH=-13.8 kJ·mol-1
B.升高反应a的反应温度,乙醇的转化率减小
C.2H2(g)+O2(g)=2H2O(g) ΔH=-229 kJ·mol-1
D.制取等量的氢气,反应b吸收的能量更少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量的关系如图所示。
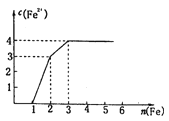
溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1:1:1B.1:3:1C.1:1:4D.3:3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大短周期元素,A的最外层电子数是其电子层数2倍;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于其它电子层上的电子数之和。
(1)A元素名称为______,D在周期表中的位置________,离子半径大小B___C(填“>”“<”或“=”)。
(2)B的两种单质在常温下都是气体,它们互为____________。比较B的氢化物和D的氢化物沸点:B___D(填“>”“<”或“=”),原因是_________________。
(3)E中含有化学键类型:_________,属于___________化合物(填“离子化合物”或“共价化合物”)。
(4)用电子式表示C与D的二元化合物的形成过程:_____________________。
(5)氢原子与B分别形成10电子和18电子分子,写出18电子分子转化成10电子分子的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com