
【题目】(1)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
①若130gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___。
②该反应中的氧化剂是___,氧化产物是___。
(2)O3能与KI溶液反应,生成一种能使带火星木条复燃的气体,向反应后溶液中滴入酚酞变为红色,若滴入淀粉溶液则变为蓝色。为测定大气中O3的含量,将0℃、1.01×105Pa、33.6m3的空气通入KI溶液,使之完全反应,再向所得溶液中滴加0.01mol/L的Na2S2O3溶液60mL恰好与之完全反应。(I2与Na2S2O3的反应式:2NaS2O3+I2=Na2S4O6+2NaI)
①写出并配平O3与KI溶液反应的化学方程式___;
②计算大气中O3的体积分数(即O3的体积与空气体积的比值,用科学记数法表示)___。
【答案】67.2L NaN3 N2 2KI+O3+H2O=2KOH+I2+O2 2×10-7
【解析】
(1)①根据方程式计算生成氮气的物质的量,再根据V=nVm计算氮气的体积;
②氧化还原反应中,所含元素化合价降低的反应物为氧化剂,对应还原产物,所含元素化合价升高的反应物为还原剂,对应氧化产物;
(2)①臭氧能与KI溶液反应,生成一种能使带余烬木条复燃的气体,该气体为氧气,向反应后溶液中滴入酚酞变为红色,溶液呈碱性,故有KOH生成,若滴入淀粉溶液则变为蓝色,说明还有生成I2,据此配平书写方程式;
②根据n=cV计算n(Na2S2O3),根据关系式O3~I2~2Na2S2O3计算n(O3),根据V=nVm计算O3的体积,再利用体积分数的定义计算。
(1)①130gNaN3的物质的量=![]() =2mol,设生成氮气的物质的量为n,则:
=2mol,设生成氮气的物质的量为n,则:
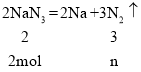
解得n=3mol
故标况下生成氮气的体积=3mol×22.4L/mol=67.2L,
故答案为:67.2L;
②2NaN3=2Na+3N2↑,反应物NaN3中氮元素化合价升高,Na元素化合价降低,所以NaN3既是氧化剂又是还原剂,钠为还原产物,N2为氧化产物,
故答案为:NaN3;N2;
(2)①臭氧能与KI溶液反应,生成一种能使带余烬木条复燃的气体,该气体为氧气,向反应后溶液中滴入酚酞变为红色,溶液呈碱性,故有KOH生成,若滴入淀粉溶液则变为蓝色,说明还有生成I2,根据氢元素守恒可知,水为反应物,故反应方程式为:2KI+O3+H2O=2KOH+I2+O2,
故答案为:2KI+O3+H2O=2KOH+I2+O2;
②n(Na2S2O3)=0.01mol/L×0.06L=6×10-4mol,则:
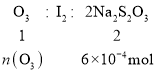
故n(O3)=![]() =3×10-4mol
=3×10-4mol
V(O3)=3×10-4mol×22.4L/mol=6.72×10-3L=6.72×10-6m3,
故大气中臭氧的体积分数为![]() =2×10-7,
=2×10-7,
故答案为:2×10-7。


科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量 ________(填“大于 ”、“等于 ” 或“小于 ”)途径Ⅱ放出的热量。
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量_____(填“大于”、“等 于”或“小于 ”)生成物具有的总能量,那么在化学反应时,反应物就需要_____(填“放出 ” 或“吸收 ”)能量才能转化为生成物,因此其反应条件是____;
(3)b与a、c、d 的数学关系式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.30g乙酸和葡萄糖混合物中的氢原子数为2NA
B.标准状况下,22.4L的H2和22.4L的F2气混合后,气体分子数为2 NA
C.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12 NA
D.标准状况下,2.24LC2H6含有的共价键数为0.6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室用NaClO4、NH4Cl等原料制取(部分物质的溶解度如图1、图2),其实验流程如图3:
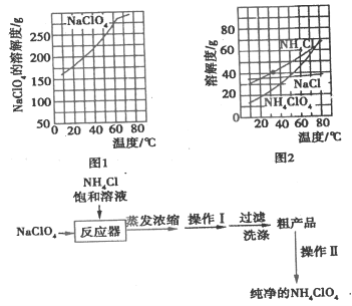
(1)反应器中发生反应的基本反应类型是________。
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为________。
(3)洗涤粗产品时,宜用________(填“0℃冷水”或“80°C热水”)洗涤。
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
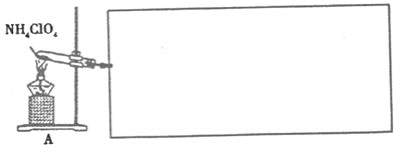
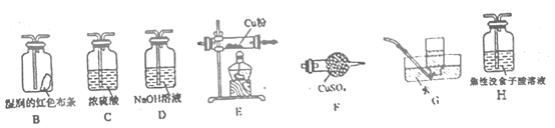
①写出高氯酸铵分解的化学方程式________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→________(填装置对应的字母),证明氧气存在的实验现象为________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁与稀硝酸之间的反应,某同学设计装置如下:
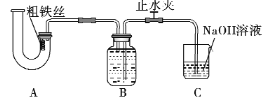
下列有关说法错误的是
A.从U型管左侧加入稀硝酸,应该打开右边的止水夹,否则硝酸无法完全浸没铁丝
B.反应结束后,在A装置中检测到了Fe2+,说明过量稀硝酸只能将铁氧化到正二价
C.B装置的作用是收集还原产物NO的,该气体不适合用排空气法收集
D.C装置吸收尾气需要O2参与反应:4NaOH +4NO +3O2 =4NaNO3 +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学计量是化学学习的工具,请回答下列问题:
(1)标准状况下,1.7gNH3与__LH2S气体含有的氢原子数相同。
(2)VmLAl2(SO4)3溶液中含Al3+ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是___mol/L。
(3)常温常压下22.4LCO2中分子个数__64克SO2的分子个数(填“>”、“<”或“=”)。
(4)标准状况下,33.6L的NH3所含电子的物质的量约为__mol。
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为__。
(6)某盐混合溶液含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=___。
(7)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为___,NH3的体积分数(即NH3的体积与混合气体总体积的比值)为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
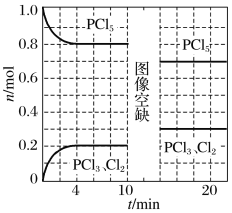
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由苯乙烯经下列反应可制得B、H两种高分子化合物,它们都是常用的塑料。
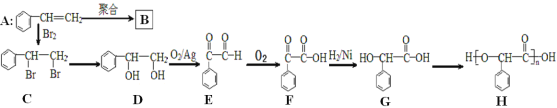
(1)G中所含官能团的名称为_____。
(2)聚合物B的结构简式是________;E的分子式是______________。
(3)C转化为D的化学方程式是_______________(应注明条件); F转化为G的反应类型属于______。
(4)写出G的一种符合下列条件的同分异构体X结简式_______________。
①X与FeCl3 溶液反应显色,也能发生银镜反应和水解反应,②X分子苯环上只有两个互为对位的取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油通过分馏和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。如图是由乙烯为原料生产某些化工产品的转化关系图。
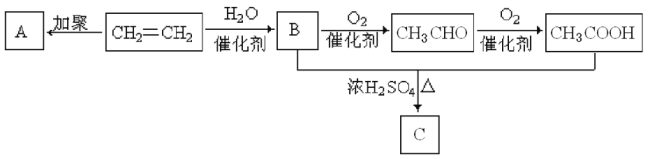
据此回答下列问题:
(1)写出乙烯的一种工业用途:__________,指出B+CH3COOH![]() C的反应类型:__________。
C的反应类型:__________。
(2)写出C的结构简式:__________。
(3)写出乙烯![]() A的化学反应方程式:__________。
A的化学反应方程式:__________。
(4)写出乙烯![]() B的化学反应方程式:__________。
B的化学反应方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com