
【题目】丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量 ________(填“大于 ”、“等于 ” 或“小于 ”)途径Ⅱ放出的热量。
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量_____(填“大于”、“等 于”或“小于 ”)生成物具有的总能量,那么在化学反应时,反应物就需要_____(填“放出 ” 或“吸收 ”)能量才能转化为生成物,因此其反应条件是____;
(3)b与a、c、d 的数学关系式是_____________________________________。
【答案】等于 小于 吸收 加热 ![]()
【解析】
(1)根据盖斯定律来判断两种途径放热之间的关系;
(2)该反应属于吸热反应,反应物具有的总能量小于生成物的总能量;
(3)途径I:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-a kJmol-1
途径II:②C3H8(g)═C3H6(g)+H2(g)△H=+b kJmol-1
③2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=-c kJmol-1
④2H2(g)+O2(g)═2H2O(l)△H=-d kJmol-1反应①=反应②+反应③×![]() +反应④×
+反应④×![]() ,据盖斯定律来判断各步反应之间的关系。
,据盖斯定律来判断各步反应之间的关系。
(1)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样;
(2)由于C3H8(g)═C3H6(g)+H2(g)的反应中△H>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量;
(3)途径I:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=akJmol1
途径II:②C3H8(g)═C3H6(g)+H2(g)△H=+bkJmol1
③2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=ckJmol1
④2H2(g)+O2(g)═2H2O(l)△H=dkJmol1反应①=反应②+反应③×![]() +反应④×
+反应④×![]() ,据盖斯定律来判断各步反应之间的关系所以a=b+
,据盖斯定律来判断各步反应之间的关系所以a=b+![]() ×(cd),所以b=a+
×(cd),所以b=a+![]() ×(c+d),2b=c+d2a,即b=
×(c+d),2b=c+d2a,即b=![]() +
+![]() a=
a=![]() 。
。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol A和1mol B气体加入体积为1L的密闭容器中,发生反应2A(g)+B(g) = 2C(g),若经2秒后测得C的浓度为0.6mol·L-1,现有下列几种说法,其中正确的是 ( )
①用物质A表示的反应平均速率为0.3mol·L-1·S-1
②用物质B表示的反应的平均速率为0.6mol·L-1·S-1
③2 s时物质A的转化率为30%
④2 s时物质B的浓度为0.7mol·L-1
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.将少量SO2气体通入过量氨水中:SO2+NH3·H2O=NH![]() +HSO
+HSO![]()
B.铝溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO![]() +3H2↑
+3H2↑
C.用醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.用KIO3氧化酸性溶液中的KI:5I-+IO![]() +3H2O=3I2+6OH-
+3H2O=3I2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应常用于冶炼高熔点金属,某小组探究Al粉与Fe3O4发生反应所得黑色固体的成分,实验过程及现象如下:
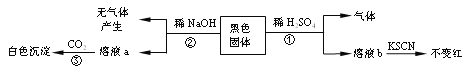
下列说法不正确的是
A.反应①产生的气体是H2B.反应②为:Al2O3 +2OH-=2AlO2-+H2O
C.反应③的白色沉淀是Al(OH)3D.黑色固体中不含Al和Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一。已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)![]() 2NO(g)ΔH1=a kJ·mol-1
2NO(g)ΔH1=a kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g)ΔH2=b kJ·mol-1
2NO2(g)ΔH2=b kJ·mol-1
③CO(g)+![]() O2(g)
O2(g)![]() CO2(g)ΔH3=c kJ·mol-1
CO2(g)ΔH3=c kJ·mol-1
④2CO(g)+2NO(g)![]() N2(g)+2CO2(g)ΔH4
N2(g)+2CO2(g)ΔH4
请回答下列问题:
(1)根据反应①②③,确定反应④中ΔH4=________ kJ·mol-1。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=____________________________________(用表达式表示)。
(3)下列情况能说明反应②已达平衡状态的是________(填字母)。
a.单位时间内生成1 mol NO2的同时消耗了1 mol NO
b.在恒温恒容的容器中,混合气体的密度保持不变
c.在绝热恒容的容器中,反应的平衡常数不再变化
d.在恒温恒压的容器中,NO的体积分数保持不变
(4)试分析高温下不利于反应③自发进行的原因______________________________。
(5)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图所示的曲线。试分析实际化工生产中不采用高压的原因______________________________。

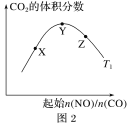
(6)探究反应④中平衡时CO2的体积分数与反应物中起始n(NO)/n(CO)的比值、温度的关系,得到如图所示的曲线。在X、Y、Z三点中,CO的转化率从大到小的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图所示。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e—===Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e—===H·
C. 鼓入空气时,每生成1mol·OH有2 mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
①若130gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___。
②该反应中的氧化剂是___,氧化产物是___。
(2)O3能与KI溶液反应,生成一种能使带火星木条复燃的气体,向反应后溶液中滴入酚酞变为红色,若滴入淀粉溶液则变为蓝色。为测定大气中O3的含量,将0℃、1.01×105Pa、33.6m3的空气通入KI溶液,使之完全反应,再向所得溶液中滴加0.01mol/L的Na2S2O3溶液60mL恰好与之完全反应。(I2与Na2S2O3的反应式:2NaS2O3+I2=Na2S4O6+2NaI)
①写出并配平O3与KI溶液反应的化学方程式___;
②计算大气中O3的体积分数(即O3的体积与空气体积的比值,用科学记数法表示)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com