
【题目】某同学组装了如图所示的电化学装置,电极I为Al,其他电极均为Cu,下列说法正确的是

A. 盐桥中通常装有含琼脂的KCl饱和溶液,起作用是平衡电荷,电池工作时,K+、Cl-会分别进入两边的溶液中
B. 该装置工作一段时间后,电极III上有红色固体析出
C. 该装置工作一段时间后,③号烧杯中电解质溶液浓度不变,两个电极的质量不变
D. 该装置工作时,③号烧杯中的SO42-向电极IV移动
【答案】A
【解析】
电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅱ是正极、Ⅲ是阳极,电流方向从正极流向负极,负极失电子发生氧化反应,正极上得电子发生还原反应,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,以此解答该题。
A. 盐桥中通常装有含琼脂的KCl饱和溶液,电池工作时,盐桥通过离子移动导电,所以K+、Cl-会分别进入两边的溶液中,故A正确;
B、电极Ⅲ是电解池阳极,电极Ⅲ的电极反应式是Cu-2e-=Cu2+,电极III上没有红色固体析出,故B错误;
C. 电极Ⅲ的电极反应式是Cu-2e-=Cu2+、Ⅳ的电极反应式是Cu2++2e-=Cu,③号烧杯是电镀池,该装置工作一段时间后,电解质溶液浓度不变,电极Ⅲ减轻、电极Ⅳ质量增大,故C错误;
D. ③号烧杯是电镀池,阴离子移向阳极,SO42-向电极III移动,故D错误。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
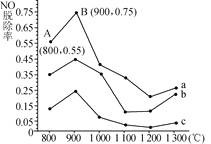
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线________(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是____________。
(3)NO氧化反应:2NO(g)+O2(g)2NO2(g)分两步进行,其反应过程能量变化示意图如图:

Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:______。

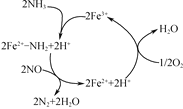
(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:

研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按图装置进行制取。

已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是___________________。
(2)B中产生ClO2的化学方程式_________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_______,检验该离子的方法是____________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
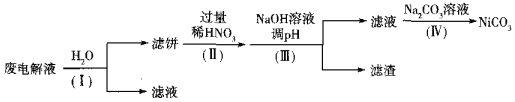
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过______方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
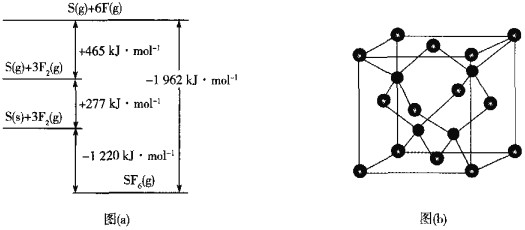
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以通过电解NO2制备NH4NO3,其工作原理如图所示,下列说法正确的是
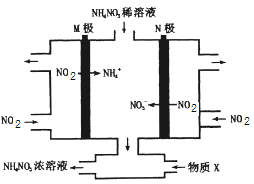
A. 电解过程中,阴极区NO2流入速率比阳极区NO2流入速率快些
B. 阴极区消耗1molNO2需补充6mol化合物X
C. 阳极反应为:NO2+e-+H2O=NO3-+2H+
D. 电解过程中,阴极区的pH小于阳极区的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电极500mlKCl和Cu(NO3)2组成的混合溶液,一段时间后两极都得到22.4L(标准状况下)气体,电解后将溶液混合均匀后呈中性,则此溶液中NO3-的物质的浓度为
A. 2mol·L-1B. 1.2mol·L-1C. 4mol·L-1D. 1mol·L-1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个热化学方程式:2H2(g) + O2(g) = 2H2O(1) ΔH= -571.6 kJmol-1,C3H8(g) + 5O2(g)= 3CO2(g) + 4H2O(l) ΔH= -2220 kJmol-1,下列说法正确的是( )
A.相同质量H2和C3H8分别完全燃烧,C3H8放出的热量多
B.C3H8 完全燃烧生成1mol H2O(l)放出的热量为555 kJ
C.l mol H2和2 molC3H8 组成的混合气体完全燃烧放出的热量为5011.6 kJ
D.H2和C3H8的混合气体共4mol,完全燃烧时放出3256 kJ热量,则 n(H2):n(C3H8)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用浓硫酸和乙醇制取乙烯,并验证探究乙烯与溴反应。实验装置如下(省略夹持、搅拌、加热装置)。
装置1 装置2
装置2 
请回答:
(1)仪器b的名称是_________;
(2)加热前,需将乙醇和浓硫酸混合。仪器a中盛装的是_________;
(3)乙醇制取乙烯的化学反应方程式为_________________;
(4)实验结果讨论:①甲同学观察到装置1中溴水颜色褪去,认为乙烯与溴水发生加成反应。化学反应方程式为____;
②乙同学观察到反应混合液逐渐变黑,认为乙烯中可能混有一种还原性气体,它也能使溴水颜色褪去。为证明乙烯能使溴水褪色,需将装置1虚线部分换成装置2,重做实验。装置2中,C所盛试剂是___;
③丙同学认为甲同学在观察实验现象时,漏掉一个能够证明乙烯与溴水发生了反应的重要实验现象。该现象是指_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com