
【题目】下列各组物质,按酸、混合物、碱顺序排列的是
A. 空气、硫酸铜、硫酸 B. 乙酸、空气、纯碱
C. 氧化铁、胆矾、熟石灰 D. 硝酸、蔗糖水、氢氧化铁
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
![]()
![]()
Ⅰ.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
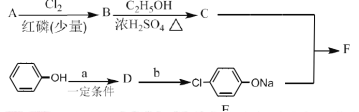
(1)A为一元羧酸,8.8gA与足量![]() 溶液反应生成2.24L
溶液反应生成2.24L![]() (标准状况),A的分子式为__________。
(标准状况),A的分子式为__________。
(2)写出符合A分子式的所有甲酸酯的结构简式:__________。
(3)B是氯代羧酸,其核磁共振谱有两个峰,写出![]() 的反应方程式:__________。
的反应方程式:__________。
(4)![]() 的反应类型为__________。
的反应类型为__________。
(5)写出A和F的结构简式:A.__________;F.__________。
(6)D的苯环上有两种氢,它所含官能团的名称为__________;写出a、b所代表的试剂:a.__________;b.__________。
Ⅱ.(7)有机物H的分子式为![]() ,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)______________________.
,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
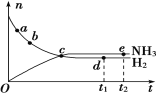
A. 点a的正反应速率比点b的小B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6 | B12结构单元 |
结构模型示意图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | 熔点1873 K |
A. HCN的结构式为H—C≡N,分子中“C≡N”键含有1个σ键和2个π键
B. 固态硫S8属于原子晶体,分子中S原子采用sp3杂化
C. SF6是由极性键构成的非极性分子,分子构型为八面体型
D. 单质硼属于原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于温度与反应方向的关系,下列判断不正确的是( )
A.ΔH<0,ΔS>0,所有温度下反应自发进行
B.ΔH>0,ΔS>0,所有温度下反应自发进行
C.ΔH<0,ΔS<0,低温下反应自发进行
D.ΔH>0,ΔS<0,所有温度下反应不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。

(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
【碘的分离】得到含I2的CCl4溶液后,利用右图装置进行碘的提取并回收溶剂。

(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因____________,为了保证实验成功,请提出改进方案:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“花卉保鲜剂”是一种可以延长花期的试剂。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
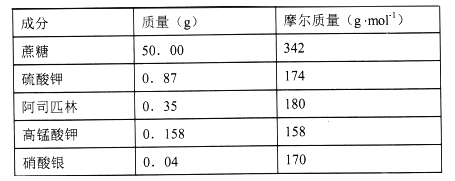
(1)下列“花卉保鲜剂”的成分中,属于非电解质的是_________。
A.高锰酸钾 B.硫酸钾 C.蔗糖 D.硝酸银 E.水
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__mol/L。
(3)配制上述500mL“鲜花保鲜剂”所需的仪器有:天平、烧杯、药匙、量筒、胶头滴管、_____。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作会使配制结果浓度偏低的是______。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液时未洗涤烧杯
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
E.加水时超过刻度线,用胶头滴管吸出
F.未冷却至室温就注入容量瓶定容
(5)“花卉保鲜剂”中高锰酸钾的主要作用是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com