
(1)如上面右图所示的原电池装置,Cu电极反应式为 ;当导线上通过2.408×1022个电子时,锌片质量减少______g。
(2)氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池,总反应方程式为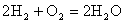 。其中氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,消耗标准状况下H2的体积是________L。
。其中氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,消耗标准状况下H2的体积是________L。
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.(新课标全国高考)常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
B.(山东高考)化合反应均为氧化还原反应
C.(山东高考)电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
D.(福建高考)易燃试剂与强氧化性试剂分开放置并远离火源
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ/mol、ΔH=-285.8 kJ/mol、ΔH=-890.3 kJ/mol、ΔH=-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ/mol
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3 kJ/mol
D. C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)
ΔH=-1 400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.锗单质是一种优良的半导体材料 B.砹化银不溶于水也不溶于稀硝酸
C.硫酸镭是难溶于水的白色固体 D.硒化氢是无色、有毒、比硫化氢稳定的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
部分短周期元素化合价与原子序数的关系如图,下列说法正确的是( )
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:W>R
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应


查看答案和解析>>
科目:高中化学 来源: 题型:
关于A(g)+2B(g)===3C(g)的化学反应,下列表示的反应速率最大的是( )
A.v(A)=0.6mol/(L·min) B.v(B)=1.2mol/(L·min)
C.v(C)=1.2mol/(L·min) D.v(B)=0.03mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) ΔH <0,下列叙述正确的是( )
2Z(g)+W(s) ΔH <0,下列叙述正确的是( )
A.平衡常数K值越大,X的最大转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子:aA 2+、bB +、cC 3-、dD - 都具有相同的电子层结构,则下列叙述正确的是 ( )
A、原子半径A>B>D>C
B、原子序数d>c>b>a
C、离子半径C>D>B>A
D、单质的还原性A>B>D>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com