
硫铁矿烧渣是一种重要的化学化工产业中间产物, 主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m流程图:

(1)实验室实现“操作I”所用的玻璃仪器有 、玻璃棒和烧杯等。
“操作III” 系列操作名称依次为: 、 、过滤和洗涤。
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式: 。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 。(4)实验室检验“反应I”已经完全的试剂是 ,现象是 。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式 。
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省枣庄市高三3月模拟考试理综化学试卷(解析版) 题型:实验题
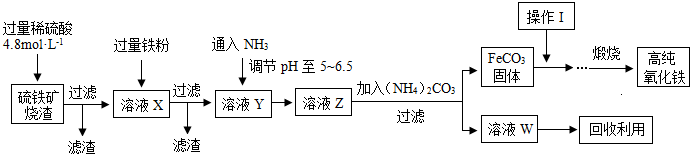
髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料。实验室用硫铁矿烧渣 (Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如下。请回答有关问题:

(1)过滤操作中的玻璃仪器为________。
(2)实验室需240mL4.8mol • L-1的硫酸溶液,若用18.4 mol • L-1的浓硫酸进行配制,所需要的最主要仪器为________。
(3)溶液X发生反应的离子方程式为________。
(4)简述如何检验溶液Z中的阴离子________。
(5)操作I的名称是________。列举W的一种用途________。
(6) 某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理,则接口的连接顺序是_______________。
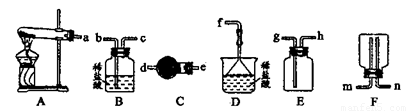
(7)将多余的氨气分别通入水中或盐酸中,若得到25℃0.1 mol.L-1的NH3 • H2O溶液或NH4Cl溶液,请你设计实验,比较NH3 • H2O的电离程度和NH4Cl的水解程度大小。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com