
【题目】Hagrmann酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
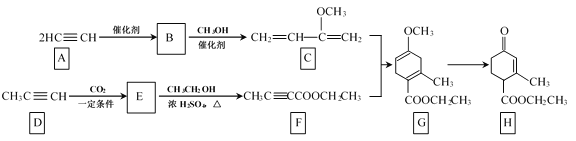
(1)B的结构简式是__;B→C的反应类型是__;H中含有的官能团名称是羰基、___。
(2)E→F的化学方程式是___。
(3)TMOB是H的同分异构体,具有下列结构特征:
①除苯环外仅有1种化学环境的H原子;
②存在甲氧基(CH3O—)。
TMOB的结构简式是___。
(4)下列说法正确的是__。
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个不饱和度
c.1molG完全燃烧生成7molH2O
d.H能发生加成、取代反应
(5)请写出乙炔和HCHO为有机原料合成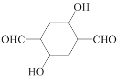 的合成路线图___(无机试剂任选)。
的合成路线图___(无机试剂任选)。
已知:①—C![]() CH+
CH+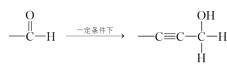
②—CHO+
(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)
……目标产物)
【答案】H![]() C-CH=CH2 加成反应 酯基,碳碳双键 CH3C
C-CH=CH2 加成反应 酯基,碳碳双键 CH3C![]() C—COOH+CH3CH2OH
C—COOH+CH3CH2OH![]() CH3C
CH3C![]() C—COOCH2CH3+H2O
C—COOCH2CH3+H2O ![]() ad CH
ad CH![]() CH
CH![]() HO—CH2—C
HO—CH2—C![]() C—CH2—OH
C—CH2—OH![]() HO—CH2—CH2—CH2—CH2—OH
HO—CH2—CH2—CH2—CH2—OH![]() OHC—CH2—CH2—CHO
OHC—CH2—CH2—CHO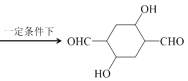
【解析】
(1)A→B为两个乙炔分子进行加成反应得到B(H![]() C-CH=CH2),然后继续与甲醇加成得到C;根据H的结构简式可知,分子中含有的官能团名称是羰基、酯基、碳碳双键;
C-CH=CH2),然后继续与甲醇加成得到C;根据H的结构简式可知,分子中含有的官能团名称是羰基、酯基、碳碳双键;
(2)E→F是酯化反应,根据F的结构简式可知E的结构简式为CH3C![]() C-COOH,反应的化学方程式是:CH3C
C-COOH,反应的化学方程式是:CH3C![]() C-COOH+CH3CH2OH
C-COOH+CH3CH2OH![]() CH3C
CH3C![]() C-COOCH2CH3+H2O;
C-COOCH2CH3+H2O;
(3)TMOB的结构中除苯环外只有一个吸收峰且存在—OCH3;H中共有3个O,故TMOB有3个—OCH3结构;又因为还有一个C,故三个—OCH3结构连在一个C上,即该物质的结构简式为![]() ;
;
(4) a.A能和HCI反应生成氯乙烯,氯乙烯加聚即得到聚氯乙烯,a正确;
b.根据结构简式可判断D中含有2个不饱和度,而F中含有3个不饱和度,b不正确;
c.G的分子式为C11H16O3,则1 mol G完全燃烧生成8mol H2O,c不正确;
d.H分子中的羰基和碳碳双键均能发生加成,酯基和饱和碳原子上的氢原子可以发生取代反应,d正确,
答案选ad;
(5)根据已知信息结合逆推法可知乙炔和HCHO合成 的路线图如下:CH
的路线图如下:CH![]() CH
CH![]() HO—CH2—C
HO—CH2—C![]() C—CH2—OH
C—CH2—OH![]() HO—CH2—CH2—CH2—CH2—OH
HO—CH2—CH2—CH2—CH2—OH![]() OHC—CH2—CH2—CHO
OHC—CH2—CH2—CHO 。
。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
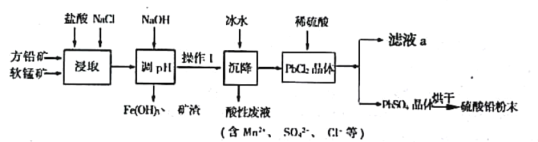
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
已知:
i.PbCl2 难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
iii.Ksp(PbSO4) =1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS 发生反应生成PbCl2和S的化学方程式为___________________;
(2)沉降操作时加入冰水的作用是____________________________;
(3)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是___________(填字母)
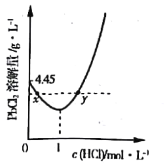
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+) 不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随HCl浓度增大,PbCl2 溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是_________________________________,操作I的方法是____________________;PbCl2“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c(SO42-)=_________________________;
(5)滤液a经过处理后可以返回到__________________工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂—三盐基硫酸(3PbO·PbSO4·H2O),写出该反应的反应方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为构成细胞的部分元素及化合物(其中a、b、c、d代表小分子物质,X,Y,Z代表大分子物质,C、H、O、N、P代表化学元素)。请分析回答下列问题。
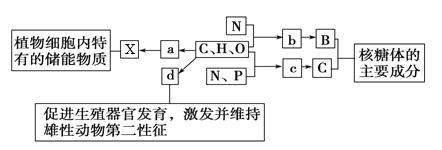
(1)物质a是________,检验物质a的常用试剂是_____。在动物细跑内,与物质X作用最似的物质是______。与物质X组成元素相同,在动物、植物细胞中均可含有的最理想的储能物质是______。
(2)物质b是________。若某种Y分子含有2条直链肽链,由18个b分子(平均相对分子质量为128)组成,则该Y分子的相对分子质量大约为______。
(3)物质c在人体细胞中共有________种,分子中________的不同决定了c的种类不同。
(4)物质d是________,d和________、维生素d都属于固醇类物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O俗名为“笑气”,也是一种温室气体。结合所学知识,回答下列问题:
(1)锌与极稀硝酸反应可生成N2O,该反应的化学方程式为___________,其中作氧化剂的硝酸与参与反应的硝酸的物质的量之比为___________。
(2)已知几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | N2(g) | CO2(g) |
相对能量/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
①N2O(g)和CO(g)反应生成N2(g)和CO2(g)的热化学方程式为____________。
②若其他条件不变,加入高效催化剂,该反应的焓变将_______(填“增大”、“减小”或“不变”)。
(3)碘蒸气能催化N2O的分解,反应历程(步骤)如下:
i.I2(g)2I(g)
ii.I(g)+N2O(g)=N2(g)+IO(g)
iii.2IO(g)+2N2O(g)=2N2(g)+2O2(g)+I2(g)
实验表明,在反应过程c(I)始终大于c(IO),由此推测,反应速率ii_________iii(填“>”、“<”或“=”)。
(4)一定温度下,向恒容密闭容器中充入2 mol N2O(g)和3 mol NO(g),发生反应:N2O(g)+NO(g)N2(g)+NO2(g) △H。测得N2体积分数与温度、时间的关系如图所示。
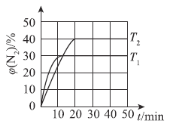
①△H___________0(填“>”、“<”或“=”)。
②下列情况表明该反应达到平衡状态的是___________(填字母)。
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和NO2的消耗速率相等 D.N2O的体积分数不再改变
③T1时,该反应的平衡常数K=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)2C(g) △H=﹣Q kJ/mol,有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为Q1 kJ。在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2kJ,已知Q1=4Q2。下列叙述不正确的是( )
A. 乙中C的转化率为20%
B. Q1+Q2=Q
C. 达到平衡后,再向乙中加入0.2 molA、0.6molB、1.6molC,平衡向正反应方向移动
D. 乙中的热化学反应方程式为2C(g)A(g)+3B(g) △H=+4Q2kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中一定能大量共存的是
A.无色透明溶液:K+、H+、MnO4-、SO32-
B.0.1mol/LCuSO4溶液:Mg2+、Al3+、NO3-、C1-
C.![]() =1×1013mol/L溶液:K+、Fe2+、SCN-、NO3-
=1×1013mol/L溶液:K+、Fe2+、SCN-、NO3-
D.能与金属铝反应产生H2的溶液:Na+、NH4+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
B | 向某溶液中逐滴加入盐酸 | 产生无色无味气体 | 此溶液中含有 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无 |
D | 先向某溶液中逐滴加入氯化钡溶液,再加稀硝酸 | 有白色沉淀产生,且沉淀不溶解 | 此溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下两种等物质的量的可燃性气体共1.68L,其中一种是烃,在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。则这两种混合气体可能为
A.H2与C4H6B.CO与C2H4C.CO与C3H6D.H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组尝试在钢制钥匙上镀铜。
实验I:将钥匙直接浸入0.4 mol·L-1 CuCl2溶液中,20s后取出,钥匙表面变红,但镀层疏松,用纸即可擦掉。
实验II:用图装置对钥匙进行电镀铜。钥匙表面迅速变红,同时有细小气泡产生,精铜表面出现少量白色固体。30s后取出钥匙检验,镀层相对实验I略好,但仍能用纸巾擦掉一部分。经调整实验条件后获得了较好的电镀产品。
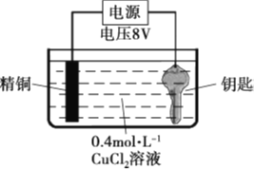
实验III:用0.4 mol·L-1 CuSO4溶液代替CuCl2溶液重复实验II,精铜表面未出现白色固体。
回答下列问题:
(1)实验I反应的化学方程式是_______。
(2)实验II中钥匙应与电源的_______极连接。
(3)钥匙表面产生的气体是_______。
(4)为了避免实验III中钥匙表面产生气体,应该采取的措施是________。
(5)常见化合物中铜元素有+1、+2两种价态,结合实验III推测实验II中精铜表面产生的白色固体的电极反应式是________。(已知CuOH是一种难溶于水的黄色固体)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com