
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
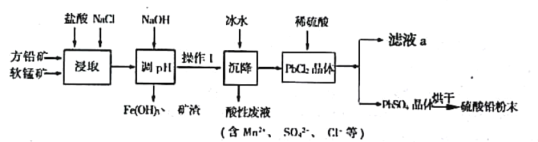
已知:
i.PbCl2 难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
iii.Ksp(PbSO4) =1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS 发生反应生成PbCl2和S的化学方程式为___________________;
(2)沉降操作时加入冰水的作用是____________________________;
(3)20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是___________(填字母)
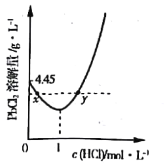
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+) 不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随HCl浓度增大,PbCl2 溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是_________________________________,操作I的方法是____________________;PbCl2“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c(SO42-)=_________________________;
(5)滤液a经过处理后可以返回到__________________工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂—三盐基硫酸(3PbO·PbSO4·H2O),写出该反应的反应方程式________________________。
【答案】MnO2+PbS+4HCl=PbCl2+S+MnCl2 +2H2O PbCl2难溶于冷水,降低PbCl2的溶解度,便于析出PbCl2晶体 BD 使Fe3+沉淀而除去 过滤 6.75×10-6 浸取 4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O
【解析】
方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)中加入稀盐酸,根据酸性废液中的成分可知该过程中PbS中部分S元素被氧化成硫酸根离子,MnO2被还原成Mn2+,加入的NaCl可促进反应PbCl2(s)+2Cl-(aq)PbCl42-(aq)平衡正向移动使更多的Pb元素存在于溶液中,加入NaOH溶液调节溶液pH,使铁离子转化成氢氧化铁沉淀,过滤得到氢氧化铁、矿渣和滤液;PbCl2难溶于冷水,将滤液液冷水沉降过滤得到PbCl2晶体,之后加入稀硫酸发生沉淀转化,生成硫酸铅晶体,过滤得到晶体烘干得到硫酸铅粉末,滤液a中主要成分为HCl。
(1)根据题意可知该过程中MnO2将PbS2中的S元素氧化成S单质,锰元素被还原成Mn2+,根据电子守恒和元素守恒可得方程式为MnO2+PbS+4HCl=PbCl2+S+MnCl2 +2H2O;
(2)根据题目信息可知氯化铅难溶于冷水,加入冰水可降低PbCl2的溶解度,便于析出PbCl2晶体;
(3)PbCl2是微溶化合物,溶于水存在下列平衡:PbCl2(s)Pb2+(aq)+2Cl-(aq),由图象可知在浓度为1mol/L时溶解量最小,小于1mol/L时,主要是电离出的氯离子抑制氯化铅的溶解,大于1mol/L时,可发生络合反应:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),而促进溶解。
PbCl42-(aq),而促进溶解。
A.Ksp(PbCl2)只受温度的影响,温度不变,则Ksp(PbCl2)不变,故A错误;
B.根据分析可知x、y两点对应的溶液中的溶质不同,所以c(Pb2+)不相等,故B正确;
C.根据分析可知当盐酸浓度大于1mol/L时,可发生反应:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
PbCl42-(aq),所以此时c(Pb2+)不一定最小,故C错误;
D.根据分析可知盐酸浓度小于1mol·L-1时,主要存在平衡PbCl2(s)Pb2+(aq)+2Cl-(aq),氯离子的增多使平衡逆向移动,故D正确;
综上所述选BD;
(4)溶液中有杂质铁离子,调pH值可使Fe3+沉淀而除去;分离固体和液体的操作为过滤;沉淀转化的方程式为PbCl2(s)+SO42-(aq)PbSO4(s)+2Cl-(aq),该反应的平衡常数K= ,所以当c(Cl-)=0.100mol/L时,c(SO42-)=
,所以当c(Cl-)=0.100mol/L时,c(SO42-)=![]() 6.75×10-6mol/L;
6.75×10-6mol/L;
(5)滤液a中的主要溶质为HCl,所以经处理后可以返回到浸取工序循环使用;反应物有PbSO4和NaOH,生成中有3PbO·PbSO4·H2O ,根据元素化合价的变化可知该反应不是氧化还原反应,所有根据元素守恒可得方程式:4PbSO4+6NaOH=3PbO·PbSO4·H2O+3Na2SO4+2H2O。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
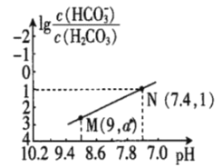
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,碘在某液态有机物M和水之间的分配比D=85(分配比D=![]() ),向两个装有20mL 0.1mol/L I2的水溶液的锥形瓶中各加入20mL、40mL M,充分振荡后静置。下列说法正确是
),向两个装有20mL 0.1mol/L I2的水溶液的锥形瓶中各加入20mL、40mL M,充分振荡后静置。下列说法正确是
A.锥形瓶中水层为无色,M层为紫色,
B.20mL中M层的I2浓度约为0.099mol/L
C.I2单质溶于有机物M时需要断裂化学键
D.40mL中M层的I2浓度大于20mL中M层的I2浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氨(NOCl)是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点-64.5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)将5g经300℃下干燥了3h并研细的KCl粉末装 50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0.002molNO2。反应12~36min即可完成,NO2红棕色消失,出现黄色亚硝酰氯,同时还得到一种盐,该盐的化学式为_____________,氯化钾需要“干燥”的原因是_____________________________。
(2)实验室可由氯气与一氧化氮在常温常压下合成亚硝酰氯,装置如图所示:
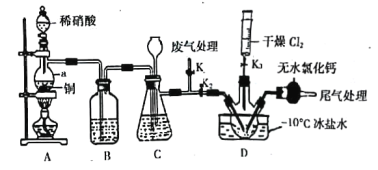
①仪器a的名称为____________________________;
②B装置的作用是____________________________;
③实验开始时,先打开K1,关闭K2、K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________________时,打开K3向装置D三颈瓶中推入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再关闭K1、K3,打开K2制备NOCl。
(3)测定产品纯度:取(2)中w g D中液态产品溶于蒸馏水,配制成250 mL溶液;用酸式滴定管准确量取25.00 mL所配制溶液于锥形瓶中,滴加几滴K2CrO4溶液作指示剂,用滴定管盛装c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。(已知:Ag2CrO4为砖红色固体,忽略杂质参与反应)
①盛装AgNO3标准溶液的滴定管是_____________(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________。
②该产品纯度为_____________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
B | 向酸性KMnO4 溶液中滴加乙醇 | 溶液褪色 | 乙醇具有还原性 |
C | 向溴水中加入苯,充分振荡、静 置 | 水层几乎无色 | 苯与溴发生了反应 |
D | 向FeCl3和BaCl2 的混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,白色沉淀为BaSO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:
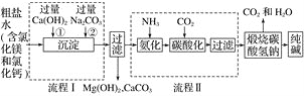
(1)上述流程图中,可循环利用的物质是____________。
(2)流程Ⅰ后过滤所得滤液中含有的溶质有__________。
(3)流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为___________。
(4)用一个化学反应方程式表示出流程Ⅱ中发生的总反应____。
(5)工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
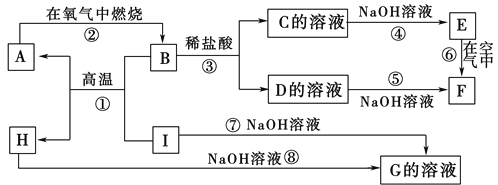
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hagrmann酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
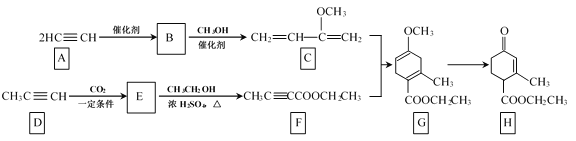
(1)B的结构简式是__;B→C的反应类型是__;H中含有的官能团名称是羰基、___。
(2)E→F的化学方程式是___。
(3)TMOB是H的同分异构体,具有下列结构特征:
①除苯环外仅有1种化学环境的H原子;
②存在甲氧基(CH3O—)。
TMOB的结构简式是___。
(4)下列说法正确的是__。
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个不饱和度
c.1molG完全燃烧生成7molH2O
d.H能发生加成、取代反应
(5)请写出乙炔和HCHO为有机原料合成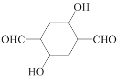 的合成路线图___(无机试剂任选)。
的合成路线图___(无机试剂任选)。
已知:①—C![]() CH+
CH+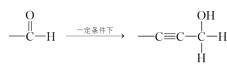
②—CHO+
(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)
……目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com