
【题目】中学教材显示“浓硫酸具有吸水性、脱水性、强氧化性,能使铁钝化”。某学习小组对“具有该四个特性的浓硫酸的浓度范围”进行了以下实验探究。
(1)配制不同浓度的硫酸用18.4 mol/L的浓硫酸配制不同浓度的硫酸。下列操作正确的是_____。
A.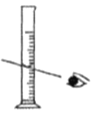 量取浓硫酸 B.
量取浓硫酸 B.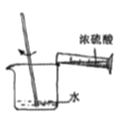 稀释浓硫酸 C.
稀释浓硫酸 C.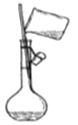 转移入容量瓶 D.
转移入容量瓶 D.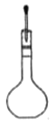 定容
定容
(2)浓硫酸的吸水性、脱水性、纯化与浓度的关系
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验 | c(H2SO4)/mol/L | 18.4 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 1-5 |
① | 胆矾颜色变化 | 蓝一白 | 蓝一白 | 蓝一白 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 |
② | 木柴梗颜色变化 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 不变 |
③ | 铁丝表面气泡 | 无 | 无 | 有 | 有 | 有 | 有 | 有 | 有 | 有 |
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:_______;当硫酸的浓度≥______mol/L时即具有脱水性。
(3)浓硫酸的强氧化性与浓度的关系
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)
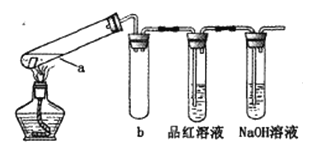
①b装置的作用是________
②本实验中证明浓硫酸具有强氧化性的现象是_________、________。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式____.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是_______.
(4)综合该小组同学的探究结果,中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为________mol/L。
【答案】 B C CuSO45H2O=CuSO4 + 5H2 O 6 安全瓶(防止液体倒吸入试管a) 铜片溶解、表面产生气泡 品红溶液退色 5Cu+4H2SO4(浓)![]() Cu2S↓+3CuSO4+4H2O 长时间加热时,水分蒸发,使硫酸浓度增大 c(H2SO4) ≥12
Cu2S↓+3CuSO4+4H2O 长时间加热时,水分蒸发,使硫酸浓度增大 c(H2SO4) ≥12
【解析】(1)用18.4 mol/L的浓硫酸配制不同浓度的硫酸。A、量取浓硫酸,视线应平视,错误;B、稀释浓硫酸应酸入水,正确;C、转移硫酸用玻璃棒引流,正确;D、定容时胶头滴管不能伸入容量瓶中,错误。正确操作为B C。
(2)硫酸铜中结晶水被浓硫酸吸收后,晶体由蓝色变为白色,CuSO45H2O=CuSO4 + 5H2 O; 根据图表信息可知,当硫酸的浓度≥6mol/L时即具有脱水性;正确答案:CuSO45H2O=CuSO4 + 5H2 O;6。
(3)①b装置的作用是防止液体倒吸入试管a,使试管炸裂,正确答案:安全瓶(防止液体倒吸入试管a)。
②铜和浓硫酸加热反应,铜片溶解、表面产生气泡, 产生的气体能够使品红溶液褪色, 浓硫酸被还原为二氧化硫气体,体现了浓硫酸具有强氧化性;正确答案:铜片溶解、表面产生气泡 ; 品红溶液褪色。
③浓硫酸与铜加热反应生成硫化亚铜、硫酸铜和水,化学方程式5Cu+4H2SO4(浓)![]() Cu2S↓+3CuSO4+4H2O;正确答案:5Cu+4H2SO4(浓)
Cu2S↓+3CuSO4+4H2O;正确答案:5Cu+4H2SO4(浓)![]() Cu2S↓+3CuSO4+4H2O。
Cu2S↓+3CuSO4+4H2O。
④铜片与5mol/L的硫酸在长时间持续加热时,水分蒸发,使硫酸浓度增大,当浓度达到c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性;正确答案:长时间加热时,水分蒸发,使硫酸浓度增大。
(4)结合表中相关信息可知中学教材中同时具有“吸水性、脱水性、使铁钝化、强氧化性”的浓硫酸的浓度范围为) c(H2SO4) ≥12mol/L;正确答案:c(H2SO4) ≥12。


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________。
II.实验室模拟下图所示流程制备亚硝酸钠:

已知:①氧化过程中,控制反应温度在35~60℃条件下主要发生反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是______,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛装的试剂除NaOH(aq)外,还可以是______(填字母)。
a.NaCl(aq) b.Na2CO3(aq) c.NaNO3(aq)
III.测定产品纯度:
【实验步骤】①准确称量ag产品配成200mL溶液;②从步骤①配制的溶液中移取20.00mL加入锥形瓶中;③用cmol/L酸性KMnO4溶液滴定至终点;④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为_____________。达到滴定终点的现象是_________。
(2)产品中NaNO2的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙醇与乙酸在浓硫酸作用下的反应装置如图(酒精灯等在图中均已略去)。试管b中盛有________溶液。加热一段时间后,试管b溶液上方有一层油状液体,该油状液体的名称是_________。乙醇与乙酸反应的化学方程式为__________________________________
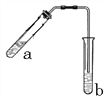
(2)某待测液中可能含有Al3+、Fe3+、Na+、NH4+、Cl-等离子,现通过如下实验对其中的阳离子进行检验:
①取少量待测液,仔细观察,呈无色;
②向上述待测液中逐滴滴加NaOH溶液至过量,先有白色沉淀生成,后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是_____,一定没有的阳离子是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为________
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)____I1(Cu)(填“>“<"或“=”)
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡略和血红素的结构如下图:
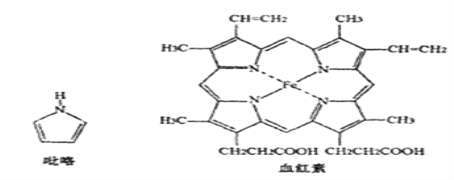
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______
②1mol吡咯分子中所含的σ键总数为____个。分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为________(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_____键相结合。
(4)黄铜矿冶炼铜时产生的SO2可经过SO2![]() SO3
SO3![]() H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
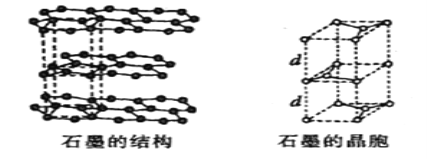
(5)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如下图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为____个。已知石墨的密度为ρg/cm3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距d=______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. 当V( NaOH )= 20mL时,pH<7
B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )
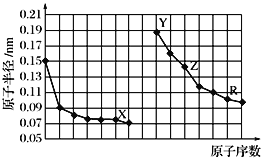
A. Z和R所形成的化合物,不能通过溶液中复分解反应而制得
B. 简单离子的半径关系是:R>Y>Z>X
C. X和Y所形成的一种化合物,可用于自来水消毒
D. 工业上获得单质Z的方法,一般是通过电解其熔融氯化物来实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com