
| A. | 家用电器起火 常用液态CO2灭火 一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液 应立即用水冲洗 边洗边眨眼睛 不可用手揉眼睛 | |
| D. | 实验后 剩余的药品不能随便丢弃 或浪费 应放回原瓶 |
分析 A.四氯化碳在灭火时由于高温的作用,产生有毒光气,属窒息性毒剂;
B.快速移到通风处,使患者吸入氧气;
C.立即揉揉眼睛会加重药液对眼的腐蚀;
D.实验剩余药品的处理原则:三不一要.
解答 解:A.四氯化碳在灭火时由于高温的作用,产生有毒光气,属窒息性毒剂,对人畜都有危害,故A正确;
B.发现有人煤气中毒,迅速关紧煤气阀,打开门窗通风,降低空气中的一氧化碳浓度,快速移到通风处,再救治,故B正确;
C.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛,以最大程度减小对眼睛的危害,故C正确;
D.实验剩余药品的处理原则:三不一要,即不能放回原瓶,也不要随意丢弃,更不要拿出实验室,要放入指定容器,故D错误.
故选D.
点评 本题考查化学实验安全及事故处理,题目难度不大,注意掌握常见事故的处理方法.


科目:高中化学 来源: 题型:解答题
| 分类标准 | 单质 | 氧化物 | 混合物 | 胶体 | 电解质 | 非电解质 |
| 属于该类的物质 | ② | ④ | ⑧⑨ | ⑦ | ③⑤⑥ | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
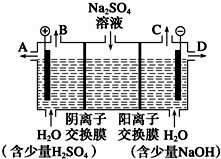 天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:2PbSO4+2H2O $?_{放电}^{充电}$Pb+PbO2+4H++2SO42-.则下列说法正确的是( )
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:2PbSO4+2H2O $?_{放电}^{充电}$Pb+PbO2+4H++2SO42-.则下列说法正确的是( )| A. | 放电时:电子方向由B到A | |
| B. | 放电时:正极反应是 Pb-2e-+SO42-═PbSO4 | |
| C. | 充电时:阳极反应是PbSO4+2H2O-2e-═PbO2+SO42-+4H+ | |
| D. | 充电时:铅蓄电池的负极应与充电器电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有I- | B. | 可能含Fe3+ | C. | 可能有Cl- | D. | 不含NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸混合:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与烧碱溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 碳酸氢钠与稀盐酸混合:HCO3-+H+═CO2↑+H2O | |
| D. | 把二氧化碳通入氯化钙溶液中:Ca2++H2O+CO2═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
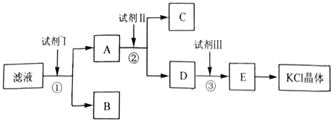
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com