
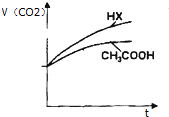
 25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )
25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )| A、电离平衡常数:CH3COOH>HX>H2CO3 |
| B、将pH=2的CH3COOH溶液和HX溶液稀释10倍后,水电离出的c(H+)较大的为HX溶液 |
| C、往10mL 0.1mol?L-1的Na2CO3溶液中缓慢滴加10mL 0.1mol?L-1的HX,混合后的离子浓度大小关系为c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
| D、当浓度均为0.1mol?L-1的CH3COOH溶液和HX的混合液用标准氢氧化钠溶液滴定至中性时,CH3COOH被完全中和 |


科目:高中化学 来源: 题型:
| A、化学变化的实质是旧键的断裂和新键的生成,有物质变化但不一定有能量变化 |
| B、氢气的燃烧热为285.8kJ?mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=285.8kJ?mol-1 |
| C、Ba(OH)2?8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
| D、已知中和热为57.3kJ?mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(H+)降低 |
| B、向水中加入少量固体醋酸钠,c(H+)增大,Kw不变 |
| C、向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH不变 |
查看答案和解析>>
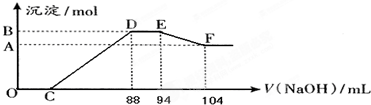
科目:高中化学 来源: 题型:
| 编号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小[ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,试根据下图所示的转化关系回答有关的问题(产物中生成的H2O等无机小分子均省略):
,试根据下图所示的转化关系回答有关的问题(产物中生成的H2O等无机小分子均省略):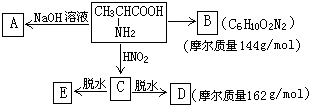
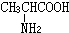 与
与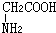 混合置于一反应容器中,一定条件下发生成肽反应,则最多生成
混合置于一反应容器中,一定条件下发生成肽反应,则最多生成查看答案和解析>>
科目:高中化学 来源: 题型:

| 编号 | (1) | (2) | (3) | (4) | (5) | (6) |
| X Y | SO2 Ba(OH)2溶液 | 盐酸 NaAlO2溶液 | 氨水 AgNO3溶液 | NaAlO2溶液 盐酸 | NaOH溶液 AlCl3溶液 | AlCl3溶液 NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| 一定条件 |
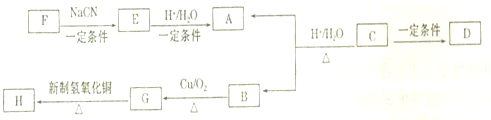
查看答案和解析>>
科目:高中化学 来源: 题型:
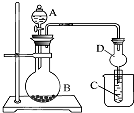
| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛氯化钙溶液,则C中溶液变浑浊 |
| C、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D、实验仪器D可以起到防止溶液倒吸的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com