
| A. | 丁烷 | B. | 丙烷 | C. | 乙烷 | D. | 戊烷 |
科目:高中化学 来源: 题型:解答题
 .
.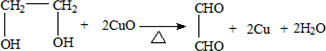 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 乙醇 | C. | 乙酸 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,18g NH4+所含的电子数为10NA | |
| B. | 56g金属铁与足量的稀盐酸反应时转移的电子数为3NA | |
| C. | 标准状况下,22.4L氧气所含的氧原子数为2 NA | |
| D. | 1 mol由Na2O2和Na2O组成的混合物,其中的钠离子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厨余垃圾 | B. | 废旧电池 | C. | 餐巾纸 | D. | 纯棉纺织品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 你选择的方案 | 合金中铝的质量分数 |
| 甲或乙或丙或丁 | $\frac{3.214V}{X}-3$或$\frac{X-Y}{X}$或$\frac{29X-12Z}{29X}$或$\frac{36W-87X}{17X}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com