
【题目】一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)H2(g)+I2(g).若[HI]由0.1molL﹣1降到0.07molL﹣1时,需要15s,那么[HI]由0.07molL﹣1降到0.05molL﹣1时,所需反应的时间为( )
A.等于5 s
B.等于10 s
C.大于10 s
D.小于10 s
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.反应是放热还是吸热,可根据反应物和生成物所具有的总能量的相对大小判断
C.任何物质中都必含有化学键
D.共价化合物中只含有共价键,离子化合物中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下:
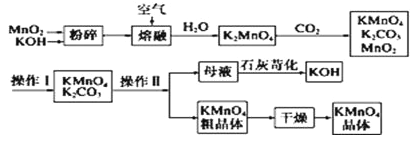
请回答下列问题:
(1)MnO2和KOH在熔融前粉碎的目的是_____________________________________________。
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要反应的化学方程式___________。
(3)通入CO2后,生成的KMnO4与MnO2的物质的量之比为___________。
(4)上述流程中可以循环使用的物质有___________、___________(填化学式)。
(5)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=___________mol/L。
(6)操作Ⅰ的名称是___________,操作Ⅱ根据下表KMnO4和K2CO3两物质在溶解性上的差异,采用___________、___________(填操作步骤)得到KMnO4粗晶体。
| 10 | 20 | 30 | 40 | 60 |
K2CO3 | 109.0 | 111.0 | 114.0 | 117.0 | 126.0 |
KMnO4 | 4.3 | 6.3 | 9.0 | 12.6 | 22.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在共价化合物中不可能含有离子键
B.阴阳离子之间通过静电引力形成的化学键,叫离子键
C.含有共价键的化合物一定是共价化合物
D.含有离子键的化合物不一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图.下列叙述正确的是( )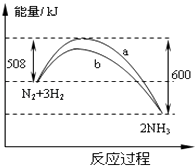
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJ/moL
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的放热增多
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】没有水,人体内大部分化学反应就无法进行,这说明 ( )
A.水在生物体内可以流动
B.生物体内的生化反应必须在水中进行
C.水是细胞内含量最多的化合物
D.水具有缓和温度变化的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如图所示,下列说法不正确的是

A. 氧元素参与了氮循环
B. ②中合成氨属于人工固氮
C. ①和③中氮元素均被氧化
D. 含氮有机物和含氮无机物可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为 ,其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如下图所示。

①电源正极为 (填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com