
ЎҫМвДҝЎҝ№ӨТөЙПУГВБНБҝуЈЁЦчТӘіЙ·ЦОӘA1203Ј¬»№ә¬УРFe203ЎўSi02Ј©МбИЎСх»ҜВБЈ¬ТұБ¶ВБөДФӯБПЈ¬МбИЎөДІЩЧч№эіМИзПВЈә
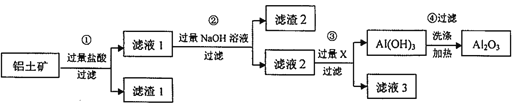
Зл»ШҙрПВБРОКМвЈә
ЈЁ1Ј©РҙіцІҪЦиўЩЦР·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪ_______Ј»ВЛФьўЩөДіЙ·ЦОӘ________ЎЈ
ЈЁ2Ј©РҙіцІҪЦиўЪЦРЙъіЙә¬ВБ»ҜәПОпөД»ҜС§·ҪіМКҪ__________________Ј»ДЬ·сҪ«ҙЛІҪЦиЦРөДNaOH ИЬТәёь»»ОӘ°ұЛ®Јҝ_________ЈЁМоЎ°ДЬЎұ»тЎ°І»ДЬЎұЈ©ЎЈИфІ»ДЬЈ¬ЗлЛөГчАнУЙЈә_________ЈЁИфДЬЈ¬ФтҙЛҝХІ»ҙрЈ©ЎЈ
ЈЁ3Ј©ІҪЦиўЫЦРөДX ОӘ______ЈЁМо»ҜС§КҪЈ©Ј¬·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘ_______ЎЈ
ЈЁ4Ј©ИфВБНБҝуөДЦКБҝОӘmkgЈ¬ЧоәуөГөҪA12O3өДЦКБҝОӘnkg(әцВФМбИЎ№эіМЦРВБФӘЛШөДЛрК§)Ј¬ФтВБНБҝуЦРВБФӘЛШөДЦКБҝ·ЦКэОӘ_____________ЈЁУГә¬mЎўn өДҙъКэКҪұнКҫЈ©ЎЈ
Ўҫҙр°ёЎҝ Fe2O3+6H+=2Fe3++3H2OЎўAl2O3Ј«6HЈ«=2Al3++3H2O SiO2 AlCl3+4NaOH=3NaCl+ Na[Al(OH)]4»тAlC13+4NaOH=3NaCl+NaAlO2+2H2O І»ДЬ ИфУГ°ұЛ®Ј¬Fe3+УлAl3Ј«ҫщіБөнЈ¬ОЮ·ЁҪ«¶юХЯ·ЦАл CO2 CO2+[Al(OH)4]-=Al(OH)3ЎэЈ«HCO3- ![]()
ЎҫҪвОцЎҝЈЁ1Ј©¶юСх»Ҝ№иУлСОЛбІ»·ҙУҰЈ¬Сх»ҜВБәНСх»ҜМъУлСОЛб·ҙУҰЈ¬ФтІҪЦиўЩЦР·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘFe2O3+6H+=2Fe3++3H2OЎўAl2O3Ј«6HЈ«=2Al3++3H2OЈ»ВЛФьўЩөДіЙ·ЦОӘSi02ЎЈЈЁ2Ј©ВЛТә1ЦРә¬УРВИ»ҜВБЈ¬әНЧгБҝЗвСх»ҜДЖ·ҙУҰЙъіЙЖ«ВБЛбДЖЈ¬МъАлЧУЧӘ»ҜОӘЗвСх»ҜМъіБөнЈ¬ТтҙЛІҪЦиўЪЦРЙъіЙә¬ВБ»ҜәПОпөД»ҜС§·ҪіМКҪОӘAlCl3+4NaOHЈҪ3NaCl+Na[Al(OH)]4»тAlC13+4NaOHЈҪ3NaCl+NaAlO2+2H2OЈ»°ұЛ®КЗИхјоЈ¬І»ДЬИЬҪвЗвСх»ҜВБЈ¬ИфУГ°ұЛ®Ј¬Fe3+УлAl3Ј«ҫщіБөнЈ¬ОЮ·ЁҪ«¶юХЯ·ЦАлЈ»ЈЁ3Ј©ВЛФь2КЗЗвСх»ҜМъЈ¬ВЛТә2ЦРә¬УРЖ«ВБЛбДЖЈ¬НЁИлЧгБҝCO2ЙъіЙЗвСх»ҜВБіБөнЈ¬·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘCO2+[Al(OH)4]-=Al(OH)3ЎэЈ«HCO3-ЎЈЈЁ4Ј©ИфВБНБҝуөДЦКБҝОӘmkgЈ¬ЧоәуөГөҪA12O3өДЦКБҝОӘnkg(әцВФМбИЎ№эіМЦРВБФӘЛШөДЛрК§)Ј¬ФтёщҫЭФӯЧУКШәгҝЙЦӘВБНБҝуЦРВБФӘЛШөДЦКБҝ·ЦКэОӘ![]() ЎЈ
ЎЈ


 ЗбЛЙ¶б№ЪИ«ДЬХЖҝШҫнПөБРҙр°ё
ЗбЛЙ¶б№ЪИ«ДЬХЖҝШҫнПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИзНјЛщКҫКЗТ»ЦЦТФТәМ¬лВЈЁN2H4Ј©ОӘИјБПЈ¬СхЖшОӘСх»ҜјБЈ¬Ді№ММеСх»ҜОпОӘөзҪвЦКөДРВРНИјБПөзіШЎЈёГ№ММеСх»ҜОпөзҪвЦКөД№ӨЧчОВ¶ИёЯҙп700~900ЎжКұЈ¬O2-ҝЙФЪёГ№ММеСх»ҜОпөзҪвЦКЦРЧФУЙТЖ¶ҜЈ¬·ҙУҰЙъіЙОпҫщОӘОЮ¶ҫОЮәҰөДОпЦКЎЈ
ПВБРЛө·ЁХэИ·өДКЗ

A. өзіШДЪөДO2-УЙөзј«ТТТЖПтөзј«јЧ
B. өзіШЧЬ·ҙУҰОӘN2H4+2O2=2NO+2H2O
C. өұјЧөзј«ЙПУР1molN2H4ПыәДКұЈ¬ТТөзј«ЙПУР1molұ»Сх»Ҝ
D. өзіШНвөзВ·өДөзЧУУЙөзј«ТТТЖПтөзј«јЧ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіИ©өД·ЦЧУКҪОӘC5H10OЈ¬ЖдКфУЪИ©АаөДН¬·ЦТм№№МеЦЦКэОӘ______ЦЦЈ»РҙіцКфУЪНӘөДИэЦЦН¬·ЦТм№№МеЈә________Ўў________Ўў________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіИЬТәЦРөОИлBaCl2ИЬТәЈ¬ІъЙъ°ЧЙ«іБөнЈ¬ФЩөОИлПЎСОЛбЈ¬іБөнІ»ИЬҪвЈ¬ФтёГИЬТәЦР
AЈ®Т»¶ЁУРSO42- BЈ®ҝЙДЬУРSO42- »тAg+ CЈ®Т»¶ЁОЮAg+ DЈ®»№ҝЙДЬУРCO32-
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУЙ¶МЦЬЖЪФӘЛШЧйіЙөДЦРС§іЈјыОЮ»ъОпAЎўBЎўCЎўDЎўEЎўXҙжФЪИзУТНјЧӘ»Ҝ№ШПөЈЁІҝ·ЦЙъіЙОпәН·ҙУҰМхјюВФИҘЈ©

ПВБРНЖ¶ПІ»ХэИ·өДКЗ( )
A. ИфXКЗNa2CO3Ј¬CОӘә¬ј«РФјьөД·Зј«РФ·ЦЧУЈ¬ФтAТ»¶ЁКЗВИЖшЈ¬ЗТDәНEІ»·ҙУҰ
B. ИфAКЗөҘЦКЈ¬BәНDөД·ҙУҰКЗOHЈӯ+HCO3Јӯ=H2O+CO32ЈӯЈ¬EТ»¶ЁДЬ»№ФӯFe2O3
C. ИфDОӘCOЈ¬CДЬәНE·ҙУҰЈ¬ФтAТ»¶ЁОӘNa2O2Ј¬ЖдөзЧУКҪКЗ![]()
D. ИфDОӘ°ЧЙ«іБөнЈ¬УлAДҰ¶ыЦКБҝПаөИЈ¬ФтXТ»¶ЁКЗВБСО
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЕЁБтЛбөДРФЦКУРЈәўЩЛбРФЎўўЪЗҝСх»ҜРФЎўўЫНСЛ®РФЎўўЬДС»У·ўРФөИЎЈТТҙјЎўде»ҜДЖәНЕЁБтЛб»мәП№ІИИЦЖұёдеТТНйКұЈ¬»бУР¶аёцёұ·ҙУҰ·ўЙъЈ¬ҙЛ№эіМЦРЕЁБтЛбПФКҫөДРФЦККЗ
AЈ®ўЩўЪўЫўЬ BЈ®ўЩәНўЪ CЈ®Ц»УРўЩ DЈ®ўЩәНўЬ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВұнКЗФӘЛШЦЬЖЪұнөДТ»Іҝ·ЦЈ¬УГПа№Ш»ҜС§УГУп»ШҙрПВБРОКМвЈә
ЦЬЖЪ | ўсA | ўтA | ўуA | ўфA | ўхA | ўцA | ўчA | 0 |
2 | A | B | C | D | ||||
3 | E | F | G | H | I | J | K | L |
ЈЁ1Ј©РҙіцHЎўIБҪЦЦФӘЛШөДГыіЖ_____________Ўў_____________ЎЈ
ЈЁ2Ј©ХвР©ФӘЛШөДЖшМ¬Зв»ҜОпЦРЧоОИ¶ЁөДКЗ________________Ј¬ФӘЛШAөДЧоёЯјЫСх»ҜОпөД·ЦЧУКҪОӘ____________Ј¬КфУЪ______________»ҜәПОпЈЁМоАлЧУ»т№ІјЫЈ©Ј»
ЖдөзЧУКҪОӘ_______________Ј»ЖдҪб№№КҪОӘ_______________ЎЈ
ЈЁ3Ј©ҙУEөҪKөДФӘЛШЦРЈ¬______ФӯЧУ°лҫ¶ЧоРЎЎЈФӘЛШEәНJРОіЙөД»ҜәПОпКфУЪ_______»ҜәПОпЈЁМоАлЧУ»т№ІјЫЈ©
ЈЁ4Ј©КФУГКөСйЦӨГчEәНFөДҪрКфРФөДЗҝИхЈЁјтКцКөСйДЪИЭәНҪбВЫЈ©_____________________________________________________________________________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБР·ҙУҰөДАлЧУ·ҪіМКҪЦРЈ¬КйРҙХэИ·өДКЗЈЁ Ј©
AЈ®Мъ·ЫёъПЎБтЛб·ҙУҰFe+2H+=Fe2++H2Ўь
BЈ®Сх»ҜВБәНПЎБтЛб·ҙУҰO2ЈӯЈ«2HЈ«=H2O
CЈ®ЗвСх»ҜұөИЬТәёъПЎБтЛб·ҙУҰBa2++SO42Јӯ=BaSO4Ўэ
DЈ®НӯУлПхЛбТшИЬТә·ҙУҰЈәCuЈ«AgЈ«=AgЈ«Cu2Ј«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіэИҘПВБРОпЦКЦРөДФУЦК(АЁәЕЦРОӘФУЦК)Ј¬ІЙУГөДКФјБәНіэФУ·Ҫ·ЁҙнОуөДКЗ( )
РтәЕ | ҙэіэФУЦК | КФјБ | іэФУ·Ҫ·Ё |
A | C2H4(SO2) | NaOHИЬТә | ПҙЖш |
B | C6H6(Br2) | Fe·Ы | ХфБу |
C | C6H5NO2(NO2) | NaOH | ·ЦТә |
D | C2H2(H2S) | CuSO4 | ПҙЖш |
A. A B. B C. C D. D
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com