
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式__________。该反应需要在加压下进行,原因是__________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种 浓度之和的分数)与pH的关系分别如图所示。
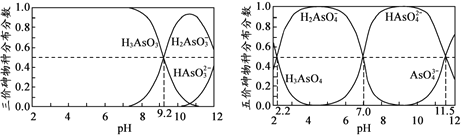
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 _____________________。 ②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1 = -lg Ka1 )。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应的ΔH________0(填“>”或“<”)。
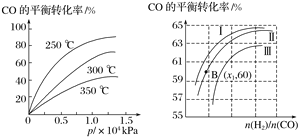
图表示CO的平衡转化率与起始投料比、温度的变化关系,测得B(x1,60)点氢气的转化率为40%,则x1=__________。
②一定条件下,将2 mol CO和2 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=________。
【答案】
![]() 加压可以增加反应物O2的浓度,提高As2S3的转化率 2△H1-3△H2-△H3 OH- + H3AsO3
加压可以增加反应物O2的浓度,提高As2S3的转化率 2△H1-3△H2-△H3 OH- + H3AsO3![]() H2AsO3- + H2O 2.2 < 3 4.5
H2AsO3- + H2O 2.2 < 3 4.5
【解析】
(1)砷元素原子序数为33,原子核外有四个电子层,最外层5个电子,据此写出原子结构示意图;
(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,结合氧化还原反应电子守恒和原子守恒书写化学方程式,反应为气体体积减小的反应,增大压强提高反应速率,平衡正向进行,反应效率高;
(3)①As(s)+3/2H2(g)+2O2(g)=H3AsO4(s)△H1;②H2(g)+1/2O2(g)=H2O(l)△H2;③2As(s)+5/2O2(g)=As2O5(s)△H3,盖斯定律计算得到反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H;
(4)①根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应;
②根据Ka1=c(H2AsO4)c(H+)/c(H3AsO4)进行计算;
(5)①由图1可知,温度升高CO的转化率降低,说明升高温度,平衡逆向移动,正向是放热反应,ΔH<0;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大,所以K1、K2、K3的大小关系为K1>K2>K3,测得B(X1,60)点氢气的转化率为40%,CO的转化率是60%,设B点时CO、H2的物质的量分别是m、n,可得60%m=40%n/2,所以n/m=3,即x1=3;
②设平衡时CO的浓度是x,则氢气的浓度是2x-1,生成甲醇的浓度是1-x,根据题意得:x/(2x-1)=2:1,x=2/3mol/L,所以K=(1-x)/x·(2x-1)2=4.5L2·mol-2。
(1)砷元素原子序数为33,原子核外有四个电子层,最外层5个电子,原子结构示意图为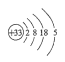 ,故答案为:
,故答案为: 。
。
(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S,增大压强,可增大反应速率,并使平衡正向移动,增大反应物的转化率,故答案为:2As2S3+5O2+6H2O=4H3AsO4+6S;加压可以增加反应物O2的浓度,提高As2S3的转化率。
(3)已知:①As(s)+3/2H2(g)+2O2(g)=H3AsO4(s)△H1,②H2(g)+1/2O2(g)=H2O(l)△H2,③2As(s)+5/2O2(g)=As2O5(s)△H3,则利用盖斯定律将①×2-②×3-③可得As2O5(s)+3H2O(l)=2H3AsO4(s)△H=2△H1-3△H2-△H3,故答案为:2△H1-3△H2-△H3。
(4)①根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3-浓度增大,说明碱和H3AsO3生成H2AsO3-,该反应为酸碱的中和反应,同时还生成水,离子方程式为
②Ka1=c(H2AsO4)c(H+)/c(H3AsO4),pH=2.2时c(H+)=10-2.2mol/L,c(H3AsO3)=c(H2AsO3-),pKa1=-lgKa1=-lgc(H2AsO4)c(H+)/c(H3AsO4)=2.2,故答案为:2.2。
(5)①由图1可知,温度升高CO的转化率降低,说明升高温度,平衡逆向移动,正向是放热反应,ΔH<0;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大,所以K1、K2、K3的大小关系为K1>K2>K3,测得B(X1,60)点氢气的转化率为40%,CO的转化率是60%,设B点时CO、H2的物质的量分别是m、n,可得60%m=40%n/2,所以n/m=3,即x1=3;故答案为:<,3。
②设平衡时CO的浓度是x,则氢气的浓度是2x-1,生成甲醇的浓度是1-x,根据题意得:x/(2x-1)=2:1,x=2/3mol/L,所以K=(1-x)/x·(2x-1)2=4.5L2·mol-2,故答案为:4.5。


科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为:
锌粒:Zn + 2OHˉ— 2eˉ= ZnO + H2O
石墨:O2 + H2 + 2eˉ = 2OHˉ。
根据判断,锌片
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子材料M的结构简式为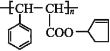 ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
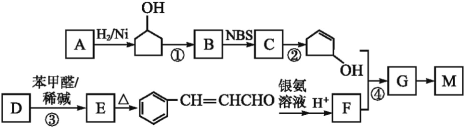
已知:①A分子中有两种不同环境的氢原子
②CH3CH2CH![]() CH2
CH2![]() CH3CHBrCH
CH3CHBrCH![]() CH2
CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH
CH3CH![]() CHCHO+H2O
CHCHO+H2O
请回答以下问题:
(1)A的结构简式为____,B的名称为____,F中所含官能团的名称是__________。
(2)①和③的反应类型分别是____、____;反应②的反应条件为_____________。
(3)反应④的化学方程式为_____________________________________________。
(4)有机物E有多种同分异构体,其中同时符合下列条件的同分异构体有___种。
①属于芳香酯类 ②其酸性水解产物遇FeCl3显紫色
(5)以1-丙醇和NBS为原料可以制备聚丙烯醇(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
A![]() B……
B……![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。
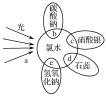
Ⅰ.(1)能证明氯水具有漂白性的是________(填“a”、“b”、“c”或“d”)。
(2)c过程中的现象是__________________________________________________;
e过程中的现象是_________________________________________________,
e过程的反应方程式____________________________________________;
b过程中的化学方程式为______________________________________________。
(3)久置的氯水变为______,用化学反应方程式表示为_____________________。
(4)实验室保存饱和氯水的方法是_______________________________。
Ⅱ.用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中。当滴到最后一滴时红色突然褪去。试分析退色的原因:
(1)是由于__________________________________________;
(2)是由于___________________________________________________。
简述怎样用实验证明红色褪去的原因是(1)还是(2):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学能与热能的说法正确的是( )
A. 铝热反应属于吸热反应
B. 若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应
C. H2→H+H的变化需要吸收能量
D. 凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
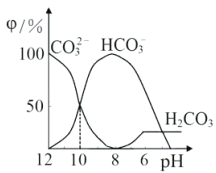
A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com