
如图为某化学反应速率—时间图像。在t1时刻升高温度和增大压强都符合下图所示变化的反应是( )

A.2SO2(g)+O2(g)2SO3(g) ΔH<0
B.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0
C.H2(g)+I2(g)2HI(g) ΔH>0
D.C(s)+H2O(g)CO(g)+H2(g) ΔH>0
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.天然油脂的分子中含有酯基,属于酯类
B.苯的分子式为C6H6,分子中的碳原子远远没有饱和,因此能和氯水发生加成反应
C.所有卤代烃都难溶于水,且都是密度比水大的液体
D.天然气与液化石油气的成分相同,与水煤气的成分不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.氯化铵溶液呈酸性:NH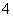 NH3+H+
NH3+H+
B.氢硫酸的电离:H2S2H++S2-
C.向小苏打溶液中加入醋酸溶液:HCO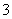 +H+CO2↑+H2O
+H+CO2↑+H2O
D.在标准状况下,向10 mL 0.1 mol·L-1的FeBr2溶液中通入22.4 mL Cl2:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在一定温度下,有下列反应发生:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)
该反应的平衡常数表达式K=________。
(2)在配制FeCl3溶液时,加入少许浓盐酸,其目的是:
_____________________;
不断加热FeCl3溶液,蒸干其水分并灼烧固体,最后得到的物质是________。
(3)已知:Fe2O3(s)+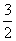 C(s)===
C(s)===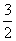 CO2(g)+2Fe(s)
CO2(g)+2Fe(s)
ΔH=+234.1 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
则2Fe(s)+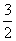 O2(g)===Fe2O3(s)的ΔH是____。
O2(g)===Fe2O3(s)的ΔH是____。
(4)Fe(OH)2在空气中短时间内可被氧化为Fe(OH)3,发生的反应为:4Fe(OH)2+O2+2H2O===4Fe(OH)3,下列说法中错误的是________(填字母)。
A.该反应是能自发进行的反应
B.该反应是熵增加的反应
C.该反应是化合反应
D.该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原电池和电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极为负极
B.电解池中与直流电源负极相连的一极为阴极
C.原电池中相对活泼的一极为正极
D.电解池中发生氧化反应的一极为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示0.1 mol/L NaHCO3溶液中有关微粒浓度(mol/L)的关系式中,正确的是( )
A.c(Na+)>c(HCO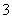 )>c(CO
)>c(CO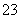 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(HCO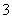 )+c(CO
)+c(CO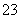 )+c(OH-)
)+c(OH-)
C.c(Na+)+c(H+)=c(HCO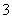 )+2c(CO
)+2c(CO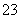 )+c(OH-)
)+c(OH-)
D.c(Na+)=c(HCO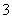 )+2c(CO
)+2c(CO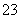 )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O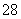 +2I-===2SO
+2I-===2SO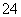 +I2 (慢)
+I2 (慢)
I2+2S2O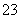 ===2I-+S4O
===2I-+S4O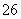 (快)
(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O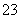 与S2O
与S2O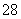 初始的物质的量需满足的关系为:n(S2O
初始的物质的量需满足的关系为:n(S2O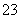 )∶n(S2O
)∶n(S2O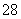 )________。
)________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx=________,理由是________________________________________
___________________________________________________________________。
(3)已知某条件下,浓度c(S2O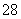 )~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O
)~反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O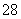 )~t的变化曲线示意图(进行相应的标注)。
)~t的变化曲线示意图(进行相应的标注)。
(4)碘也可用作心脏起搏器电源——锂碘电池的材料。
该电池反应为:2Li(s)+I2(s)===2LiI(s) ΔH
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=________;碘电极作为该电池的________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关四个常用电化学装置的叙述正确的是( )


A.图Ⅰ所示电池中,MnO2作催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O作氧化剂,在电池工作过程中被还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
一些烷烃的燃烧热如下表:
| 化合物 | 燃烧热/(kJ/mol) | 化合物 | 燃烧热/(kJ/mol) |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2—甲基丁烷 | 3 531.3 |
下列表达正确的是( )
A.正戊烷的燃烧热大约在3 540 kJ/mol左右
B.热稳定性:正丁烷<异丁烷
C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l) ΔH=-1 560.8 kJ/mol
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com