
【题目】从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12:1,H的相对分子质量为78。下列是有机物A~G之间的转化关系:
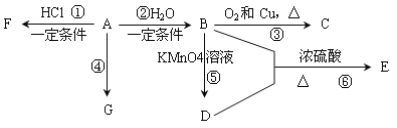
请回答下列问题:
(1)E中所含官能团的名称是___________________________;
(2)写出反应③的化学方程式_____________________________________________;
(3)G是一种高分子化合物,可以用来制造多种包装材料和农用薄膜材料等,其结构简式是______________________;
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制备F的化学方程式:_______________;
(5)等质量的A、H完全燃烧时消耗O2的物质的量_______(填“A>H、A<H或A=H”)。
【答案】酯基 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O ![]() CH2=CH2+HCl
CH2=CH2+HCl![]() CH3CH2Cl A>H
CH3CH2Cl A>H
【解析】
从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志,A是乙烯。乙烯和水发生加成反应生成B是乙醇,乙醇发生催化氧化生成C是乙醛,乙醇被酸性高锰酸钾溶液氧化生成D是乙酸,乙酸和乙醇发生酯化反应生成E是乙酸乙酯;乙烯和氯化氢发生加成反应生成F是氯乙烷;H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12:1,H的相对分子质量为78,因此H是苯,据此解答。
(1)E是乙酸乙酯,其中所含官能团的名称是酯基;
(2)反应③是乙醇的催化氧化,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)G是一种高分子化合物,可以用来制造多种包装材料和农用薄膜材料等,因此G是聚乙烯,其结构简式是![]() ;
;
(4)由A制备F的化学方程式为CH2=CH2+HCl![]() CH3CH2Cl;
CH3CH2Cl;
(5)乙烯分子中含氢量高于苯分子中含氢量,含氢量越高,在质量相等的条件下消耗的氧气越多,则等质量的A、H完全燃烧时消耗O2的物质的量是A>H。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃
B. 分子组成符合CnH2n+2的烃一定是烷烃
C. 正戊烷分子中所有的碳原子均在同一条直线上
D. 碳、氢原子个数比为1∶3的烷烃有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法不正确的是
A.1molNa变成Na+时失去的电子数为NA
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
C.0.5molH2O中所含的氢原子数目为NA
D.1molH2中所含的质子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是短周期元素,周期表中B与C相邻,C与E同主族;A中L层是K层的2倍,B的电子数比C的电子数少1个;F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的气体单质,且溶液使酚酞溶液变红。G是第三周期原子半径最小的主族元素。
(1)B在元素周期表的位置_____ ;A、B、C的氢化物稳定性顺序为_______(用分子式表示);G的阴离子的还原性_____(大于或小于)E的阴离子。
(2)F2C和F2E中,沸点较高的是____(填化学式),其主要原因是_____。
(3)B与F元素可形成18电子分子的电子式为_____。
(4)D的最高价氧化物的水化物的电子式____,用电子式表示FGC的形成过程为_______;
(5)锡(Sn)是古代五金之一,在第五周期第ⅣA,锡能和浓硫酸反应生成Sn(SO4)2和刺激性气味气体,反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对分别盛有不同无色溶液①②③④四支试管进行如下操作。现象和结论对应正确的是
操作 | 现象 | 结论 | |
A | 向①中滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
B | 向②中滴入NaHCO3溶液 | 有白色沉淀生成 | 原溶液中有AlO2- |
C | 向③中先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
D | 向④中滴加氯水和CCl4,振荡静置 | 下层溶液呈橙色 | 原溶液中有I- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α丙氨酸是组成人体蛋白的氨基酸之一,如图是α丙氨酸的分子结构模型图,下列对α丙氨酸的叙述不正确的是( )
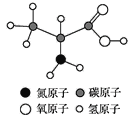
A. α丙氨酸分子由碳、氢、氧、氮四种原子构成
B. α丙氨酸中氧元素的质量分数最大
C. α丙氨酸的分子式为C3H7O2N
D. α丙氨酸与CH3CH2CH2NO2以及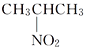 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器内发生反应N2(g)+3H2(g)![]() 2NH3(g),不可能为平衡状态的是( )
2NH3(g),不可能为平衡状态的是( )
A. NH3、N2、H2的物质的量都不再改变
B. NH3、N2、H2的体积分数都不再改变
C. 混合气体平均相对分子质量不再改变
D. 一个N≡N断裂的同时,有3个H—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如下图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后,观察到电流计指针向右偏转。下列判断不正确的是( )。
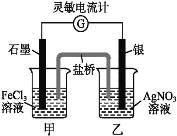
A. 在外电路中,电子从银电极流向石墨电极
B. 盐桥中的K+移向甲烧杯
C. 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
D. 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com