
【题目】A、B、C、D、E、F、G是短周期元素,周期表中B与C相邻,C与E同主族;A中L层是K层的2倍,B的电子数比C的电子数少1个;F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的气体单质,且溶液使酚酞溶液变红。G是第三周期原子半径最小的主族元素。
(1)B在元素周期表的位置_____ ;A、B、C的氢化物稳定性顺序为_______(用分子式表示);G的阴离子的还原性_____(大于或小于)E的阴离子。
(2)F2C和F2E中,沸点较高的是____(填化学式),其主要原因是_____。
(3)B与F元素可形成18电子分子的电子式为_____。
(4)D的最高价氧化物的水化物的电子式____,用电子式表示FGC的形成过程为_______;
(5)锡(Sn)是古代五金之一,在第五周期第ⅣA,锡能和浓硫酸反应生成Sn(SO4)2和刺激性气味气体,反应的化学方程式为_______。
【答案】第二周期ⅤA族 CH4<NH3<H2O 小于 H2O 水分子间存在氢键 ![]()
![]()
![]() Sn+4H2SO4=Sn(SO4)2+2SO2↑ +4H2O
Sn+4H2SO4=Sn(SO4)2+2SO2↑ +4H2O
【解析】
化合物D2C2与水反应生成C的气体单质,且所得溶液使酚酞溶液变红,说明溶液显碱性,则可推知D2C2为Na2O2,即D为Na元素,C为O元素,C与E同主族,且是短周期元素,则E为S元素,A中L层是K层的2倍,则A为C元素,B与C相邻,B的电子数比C的电子数少1个,则B为N元素,F元素的原子在周期表中半径最小,则F为H元素,G是第三周期原子半径最小的主族元素,则G为Cl元素,据此答题。
由分析可知:A为C元素,B为N元素,C为O元素,D为Na元素,E为S元素,F为H元素,G为Cl元素。
(1)B为N元素,N原子核外有2个电子层,最外层有5个电子,故位于元素周期表的第二周期第ⅤA族;A为C元素、B为N元素、C为O元素,C、N、O位于同一周期,同一周期元素的非金属性逐渐增强,其氢化物的稳定性逐渐增强,所以A、B、C的氢化物稳定性顺序为:CH4<NH3<H2O;E为S元素、G为Cl元素,S、Cl位于同一周期,同一周期的元素,元素的非金属性越强,则单质的氧化性越强,其对应阴离子的还原性越弱,所以G的阴离子的还原性小于E的阴离子,故答案为:第二周期ⅤA族,CH4<NH3<H2O,小于。
(2)F2C和F2E分别为H2O、H2S,水分子间存在氢键,H2S分子间不存在氢键,存在氢键的物质的熔沸点比没有氢键的物质的熔沸点高,所以沸点较高的是H2O,故答案为:H2O,水分子间存在氢键。
(3)B为N元素、F为H元素,N和H元素形成的含有18电子的分子为N2H4,N和H均为非金属元素,分子间形成共价键,其电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(4)D为Na元素,Na的最高价氧化物的水化物为NaOH,NaOH中含有离子键和共价键,其电子式为![]() ,FGC为HClO,次氯酸分子中Cl为+1价,共用一对电子,O为-2价,共用了两对电子,次氯酸电子式为
,FGC为HClO,次氯酸分子中Cl为+1价,共用一对电子,O为-2价,共用了两对电子,次氯酸电子式为![]() ,用电子式表示HClO的形成过程为
,用电子式表示HClO的形成过程为![]() ;故答案为:
;故答案为:![]() ,
,![]() 。
。
(5)锡(Sn)在第五周期第ⅣA,故其最高正化合价为+4价,锡能和浓硫酸反应生成Sn(SO4)2和刺激性气味气体,该刺激性气味的气体为SO2,Sn元素的化合价由


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是 ( )
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 氢氧化亚铁在空气中的变化:2Fe(OH)2+O2+H2O=2Fe(OH)3
C. 氯气溶于水:Cl2 + H2O = 2H+ + Cl-+ ClO-
D. 少量Ca(OH)2和NaHCO3反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室保存下列物质的方法中,不正确的是
A.少量金属钠保存在煤油里
B.烧碱溶液盛装在使用玻璃塞的试剂瓶中
C.FeSO4溶液存放在加有少量铁粉的试剂瓶中
D.新制氯水通常保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A. 新制氯水长时间放置颜色变浅
B. 高压比常压更有利于H2转化为NH3
C. 蒸干AlCl3溶液无法得到无水AlCl3
D. 滴加少量CuSO4溶液可以加快Zn与稀H2S04反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3 会快速分解为FeBr2。某校同学设计实验用干燥的HBr 与Fe 反应制备少量FeBr2,实验装置如下(部分夹持装置已省略),请回答相关问题:
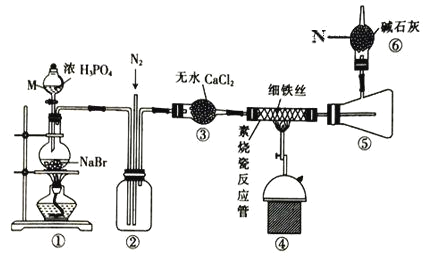
(1)仪器 M 名称是___,装置④中主要的化学方程式为__________。
(2)装置⑥的作用是___,逸出的气体主要是_____(填化学式)。
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是____。
(4)将浓磷酸换成浓硫酸同样能制得 HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制 HBr 的原因是硫酸和磷酸都具有___(填选项字母)。
a.脱水性 b.强氧化性 c.难挥发性
②溶液变橙黄色是因为发生了副反应____(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度____ (填“有”或“没有”)影响,理由是__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12:1,H的相对分子质量为78。下列是有机物A~G之间的转化关系:
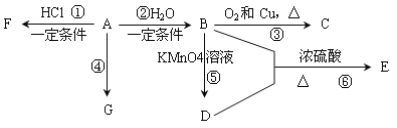
请回答下列问题:
(1)E中所含官能团的名称是___________________________;
(2)写出反应③的化学方程式_____________________________________________;
(3)G是一种高分子化合物,可以用来制造多种包装材料和农用薄膜材料等,其结构简式是______________________;
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制备F的化学方程式:_______________;
(5)等质量的A、H完全燃烧时消耗O2的物质的量_______(填“A>H、A<H或A=H”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 互为同分异构体,下列说法不正确的是
互为同分异构体,下列说法不正确的是
A. z的二氯代物有三种
B. x、y的一氯代物均只有三种
C. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D. x、y、z中只有x的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下可逆反应:Fe2(SO4)3+6KSCN![]() 2Fe(SCN)3+3K2SO4达到平衡状态后加入少量下列何种固体物质,该平衡几乎不发生移动( )
2Fe(SCN)3+3K2SO4达到平衡状态后加入少量下列何种固体物质,该平衡几乎不发生移动( )
A. NH4SCN B. K2SO4 C. NaOH D. FeCl3·6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com