
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中做辅助剂,在化学工业和制药工业中也可做氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下过程来制取。
回答下列问题:
(1)步骤Ⅰ中反应化学方程式为4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在实验室,步骤Ⅰ应在________(填“陶瓷”或“铁”)坩埚中完成。
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是________________________(用化学反应方程式表示)。
(3)步骤Ⅳ中发生反应的离子方程式为________;反应完成的标志是________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1?2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)
基本实验步骤为①溶解;②________;③________;④冷却,结晶,再过滤得K2Cr2O7晶体。其中③应在________(填“高温”或“低温”)条件下进行。
科目:高中化学 来源: 题型:填空题
某研究小组设计如下工艺路线提纯工业碳酸钠。已知工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42—等杂质。
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ.有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: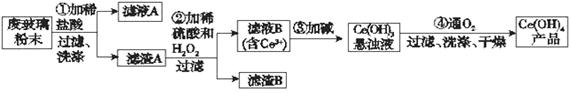
(1)洗涤滤渣A的目的是为了除去____________(填离子符号),检验该离子是否洗净的方法是_________________________________________________________。
(2)第②步反应的离子方程式是______________________________________,滤渣B的主要成分是___________________。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP______________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有_______________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水的综合利用可以制备金属镁,其流程如下图所示: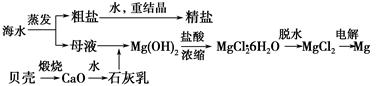
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石( Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
银氨溶液放久后会产生叠氮化银(AgN3)而引起爆炸,直接排放会污染环境,且造成银资源的浪费。某研究小组设计了从银镜反应后的废液中(含过量的银氨溶液,假设不含单质银)回收银的如下两种实验流程:
(已知:[Ag(NH3)2]+在溶液中存在平衡:[Ag(NH3)2]+??Ag++2NH3)
(1)写出甲方案第①步废液与稀HNO3反应的离子方程式 。
(2)甲方案第②步加入的铁粉要过量的目的是 。
甲方案流程可能产生的大气污染物是 。
(3)乙方案若最终得到银粉的质量偏大,排除未洗涤干净的因素,可能的原因是 。
(4)实验室配制银氨溶液的操作过程是 。
(5)已知乙方案第③步反应有H2S气体产生,若最终得到银粉21.6 g,不考虑其他损失,理论上该步需要加入铁粉 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋是生命的摇篮、资源的宝库。中国要实施海洋强国战略,实现由海洋大国向海洋强国迈进的梦想。海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。其流程如下图所示:
(1)写出①、②反应的离子方程式:
①______________________,②______________________。
(2)工业上利用电解饱和食盐水产生的氢气和氯气制取盐酸,为了体现绿色化学理念,使氯气充分反应,采取将氯气在氢气中燃烧的办法,可避免氯气燃烧不完全污染空气,请写出氯气在氢气中燃烧的实验现象:______________________。
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得到饱和NaC1溶液。现有下列除杂试剂:A.盐酸 B.氢氧化钡溶液 C.碳酸钠溶液。精制时加入过量除杂试剂的正确顺序是______________。(填序号)
(4)金属镁在空气中燃烧时,除生成MgO外,还有少量Mg3N2生成。把等物质的量的金属镁分别放在:A.纯氧气(O2)中;B.二氧化碳气体中;C.空气中。完全燃烧后,得到的固体物质的质量由大到小的顺序是______________。(填序号)
(5)将电解饱和NaCl溶液生成的氯气通入氢氧化钠溶液中可以得到NaClO。某化学兴趣小组探究NaClO与尿素CO(NH2)2的反应产物,通过实验发现产物除某种盐外,其余产物都是能参与大气循环的物质,则该反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
(1)写出步骤①、②、④分离提纯的方法:
① ; ② ; ④ 。
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 。向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论 。
(5)写出加入试剂a后,发生反应的离子方程式 。
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和石灰乳制取漂白粉的化学方程式 ________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 ;过滤操作②的滤液是 和 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol/L的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com