
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1 的溶液中:HCO![]() 、SO
、SO![]() 、K+、Cl-
、K+、Cl-
B.遇酚酞变红的溶液中:NO![]() 、Na+、、SiO
、Na+、、SiO![]() 、K+
、K+
C.c(NO![]() ) = 1 mol·L -1 的溶液中:H+、Fe2+、Cl-、NH
) = 1 mol·L -1 的溶液中:H+、Fe2+、Cl-、NH![]()
D.无色透明溶液中: K+、SO![]() 、Na+、MnO
、Na+、MnO![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法错误的是( )
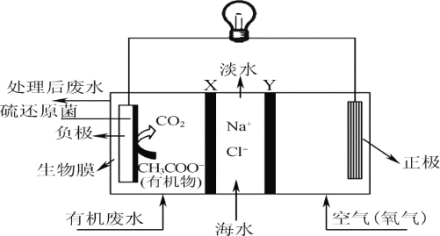
A.该装置不可以在高温下工作B.X、Y依次为阴离子、阳离子选择性交换膜
C.负极反应为CH3COO-+2H2O+8e-=2CO2↑+7H+D.该装置工作时,化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列关于铁元素及其化合物的知识:
(1)将 NaOH 溶液滴入 FeSO4溶液中,能观察到的现象是___,请写出产物颜色变化时发生的反应方程式___。
(2)实验室配制氯化铁溶液时,通常应将氯化铁固体溶解在加有少量 ___的水中; FeCl2溶液在空气中放置一段时间后,逐渐变成浅黄色,其原因是___。(用离子方程式表示)
(3)在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。该反应的化学方程式_________________,该反应中的还原剂是___,氧化剂是___。
(4)在 100mL18mol/L的浓硫酸中加入过量的铁片,加热使之充分反应,产生的气体在标准状况下的体积可能是 ___。
A.40.32L B.25.76L C.20.16L D.6.72L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
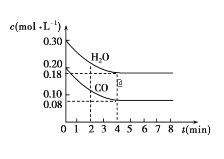
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=___mol/(L·min),v(H2)=___mol/(L·min),v(CO2)=___mol/(L·min)。
(2)请你在图中标出CO2和H2的浓度变化。___
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
CO | 0.200 | 0.138 | c1 | c1 | 0.116 | 0.096 |
H2O | 0.300 | 0.238 | c2 | c2 | 0.216 | 0.266 |
CO2 | 0 | 0.062 | c3 | c3 | 0.084 | 0.104 |
H2 | 0 | 0.062 | c4 | c4 |
①表中3min~4min之间,反应处于___状态;c1___0.08mol/L(填“大于”、“小于”或“等于”)。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是___(单选),表中5min~6min之间数值发生变化,可能的原因是___(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
A.2Na+2H2O═2NaOH+H2↑B.CaCO3+2HCl═CaCl2+H2O+CO2↑
C.2KClO3![]() 2KCl+3O2↑D.CH4+2O2
2KCl+3O2↑D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com