
| A. | 12g石墨烯(  )中含有C-C键的数目为1.5NA )中含有C-C键的数目为1.5NA | |
| B. | 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| C. | 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA |
分析 A.在石墨晶体中1个C原子对应3×$\frac{1}{3}$=$\frac{3}{2}$个C-C键;
B.过氧化氢溶液中过氧化氢、水都含有氧元素;
C.铵根离子浓度不同水解程度不同;
D.反应中氯酸钾+5价氯元素化合价降为0价,氯化氢中-1价氯化合价升高为0价,生成3mol氯气转移5mol电子.
解答 解:A.在石墨晶体中1个C原子对应3×$\frac{1}{3}$=$\frac{3}{2}$个C-C键,12g石墨物质的量为1mol,含有C-C键的数目为1.5NA,故A正确;
B.过氧化氢溶液中过氧化氢、水都含有氧元素,所以100g质量分数为17%的H2O2水溶液中含氧原子数目大于0.5NA,故B错误;
C.氨根离子为弱碱阳离子,水溶液中部分水解,所以,常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均小于0.5 NA,故C错误;
D.在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为$\frac{5}{3}$NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意盐类水解的性质及规律,题目难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
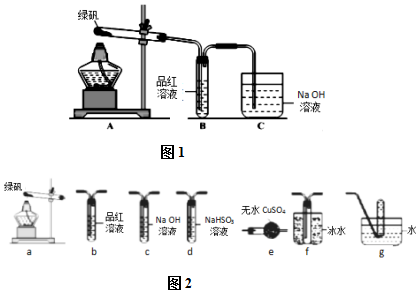
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 证明乙二酸具有还原性 | 向乙二酸溶液中滴加2 滴KMnO4溶液 |
| B | 制备Fe(OH)3胶体 | 将NaOH溶液滴加到饱和FeCl3溶液中 |
| C | 铝可以从铜盐溶液中置换铜 | 将久置在空气中的铝片放入CuSO4溶液中 |
| D | 检验蔗糖是否水解 | 取蔗糖溶液,加3~5滴稀硫酸,水浴加热5min,取少量溶液,加入银氨溶液加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 相应实验现象 | 结论或推论 | |
| A | 溴水中加入苯,充分振荡、静置 | 水层几乎呈无色 | 苯与溴发生了反应 |
| B | 一小粒金属钠投入装有无水乙醇的试管中 | 反应结束前一段时间,钠浮在乙醇表面 | 密度:乙醇大于钠 |
| C | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液和AgNO3溶液 | a中溶液变蓝,b中产生黄色沉淀 | KI3溶液中存在:I3-?I2+I- |
| D | 分别向含Mn2+的草酸溶液X和不含Mn2+的草酸溶液Y中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液在X溶液中褪色较快 | Mn2+也能还原高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g钠由原子变成离子时,失去的电子数为1NA | |
| B. | 0.2NA个硫酸分子与19.6 g磷酸含有相同的氧原子数 | |
| C. | 28 g氮气所含原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
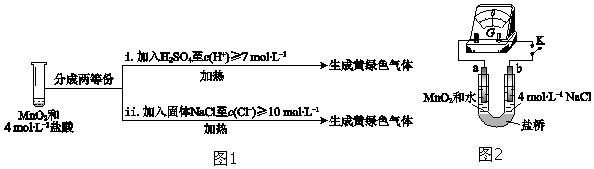
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com