
下列叙述正确的是
A.在任何条件下,等物质的量的乙烯(C2H4)和CO所含的分子数目相等
B.等物质的量的N2和CO在标准状况下的体积均为22.4L
C.同温同压下,等体积的物质所含分子数目一定相等
D.1 mol HCl中所含的分子数目和1 L 1 mol/L盐酸中所含的分子数目相同
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2016届新疆兵团农二师华山中学高三上学期第二次月考化学试卷(解析版) 题型:选择题
如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
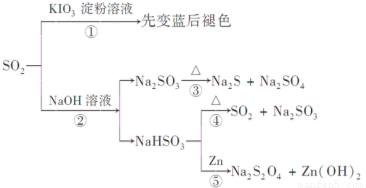
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
查看答案和解析>>
科目:高中化学 来源:2016届四川省巴中市普通高中高三10月诊断性测试理综化学试卷(解析版) 题型:填空题
利用废铁丝和工业硫酸铜废液(含硫酸亚铁)制备硫酸铜晶体。生产过程如下:
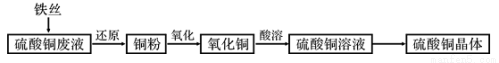
试回答下列问题:
(1)利用硫酸铜的 性质,常在游泳池中加入硫酸铜晶体杀菌消毒。
(2)废铁丝中含有铁锈((Fe2O3?xH2O))在投入硫酸铜废液前需用稀H2SO4进行处理,其主要发生反应的离子方程式_____________________。
(3)铜粉氧化过程中,颜色由粉红变为黑色,再由黑色变绿色。取绿色粉末加入稀硫酸溶液,溶液变蓝,产生无色无味气体,经检验为二氧化碳。推测该绿色粉末为 。(填化学式)
(4)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(5)硫酸铜溶液常作电解液,试写出用石墨电极电解硫酸铜溶液阳极反应式: 。
(6)在0.10mol?L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol?L-1(K sp[Cu(OH)2]=2.2×10-20)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:选择题
垃圾处理无害化、减量化和资源化逐渐被人们所认识。垃圾的分类收集是实现上述理念的重要措施。某垃圾箱上贴有如右图所示的标志,向此垃圾箱中丢弃的垃圾是

A.危险垃圾 B.可回收物
C.有害垃圾 D.其他垃圾
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期中测试化学试卷(解析版) 题型:填空题
(1)写出下列反应的化学反应方程式,用双线桥标明电子转移数目和方向,并指出反应中的氧化剂、还原剂、氧化产物和还原产物。
氯酸钾制氧气: 。
氧化剂是 ,还原剂是 ,氧化产物 ,还原产物 。
(2)已知反应:
①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O ②Cl2+SO2+2H2O=H2SO4+2HCl
1)反应①的离子方程式 ;
2)反应①中被氧化的HCl和未被氧化的HCl的物质的量之比为 ,有0.2 mol HCl被氧化,转移电子的数目是 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期期中测试化学试卷(解析版) 题型:选择题
化学与生产、生活、能源、环保等密切相关。下列有关说法正确的是
A.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
B.人造纤维、合成纤维和光导纤维都是有机高分子化合物
C.不需要通过化学反应就能从海水中获得食盐和淡水
D.绿色化学的核心是运用化学方法对环境污染进行综合治理
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列物质中,不能由单质直接化合生成的是
①CuS ②FeS ③SO3 ④H2S ⑤FeCl2
A.①③⑤ B.①②③⑤ C.①②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期10月月考化学试卷(解析版) 题型:实验题
欲用含有少量氯化钙的氯化钠固体,配制100 mLamol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
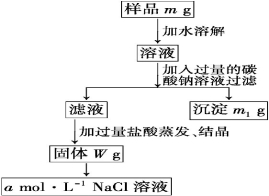
(1)称量粗盐样品mg,在托盘天平左盘上放__________________,右盘上放__________________。
(2)过滤时,漏斗下端管口应________,漏斗中液面应____________________________。
(3)蒸发操作时应将液体放在________中加热,等加热至________________________时停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是_______________,反应的化学方程式是_____________。
(5)在滤液中加入盐酸的作用是________________,反应的化学方程式是 ______________________。
(6)配制100 mLamol/L的NaCl溶液时,应从Wg固体中称取NaCl的质量为________,配制时应在____________________中进行定容。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第二次月考化学试卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式H2B=H++HB-;HB- H++B2-回答下列问题:
H++B2-回答下列问题:
(1)Na2B溶液显______(填“酸性”,“中性”,或“碱性”)。理由是___________(用离子方程式表示)。
(2)在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中氢离子的物质的量浓度可能是____0.11 mol/L(填“<”、“>”、“=”)理由是: 。
(4)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com