
【题目】在下列说法正确的是![]()
A.![]() 醋酸溶液中加入冰醋酸,电离平衡正向移动,醋酸的电离程度增大
醋酸溶液中加入冰醋酸,电离平衡正向移动,醋酸的电离程度增大
B.![]() 时,
时,![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,
的醋酸溶液等体积混合,![]()
C.![]() 溶液和
溶液和![]() 溶液分别加热蒸干并灼烧,最终都能得到
溶液分别加热蒸干并灼烧,最终都能得到![]()
D.酸碱中和滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中液面变化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。

①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列物质的性质,判断其应用错误的是![]()
A.碳酸钠溶液呈碱性,可用于清洗油污
B.水与乙醇以任意比例互溶,可用水洗、分液的方法除去溴乙烷中的乙醇
C.镧镍合金能大量吸收![]() 形成金属氢化物,可作储氢材料
形成金属氢化物,可作储氢材料
D.游泳池中常加入硫酸铜,其主要作用是铜离子水解生成![]() 胶体,能吸咐池中的悬浮物
胶体,能吸咐池中的悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由慢到快的顺序是
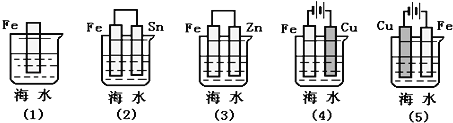
A.(5)(2)(1)(3)(4) B.(5)(1)(2)(4)(3)
C.(4)(2)(1)(3)(5) D.(4)(3)(1)(2)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为主要原料可以制备乙二醇,相关工艺流程如下:

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式_______
(2)合成气在不同催化剂作用下,可以合成不同的物质。下列物质仅用合成气为原料就能得到且原子利用率为100%的是_____填字母)。
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成份为CH4)与C02反应制备合成气。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
2H2(g)+ O2(g)= 2H2O(l) △H=-571.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
则CH4与CO2生成合成气的热化学方程式为____________________。
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:
CH3OOC—COOCH3(g)+ 4H2(g)![]() HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___________(填字母)。
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC—COOCH3+ 2H2O![]() HOOC—COOH+2CH3OH
HOOC—COOH+2CH3OH
①草酸是二元弱酸,可以制备![]() (草酸氢钾),
(草酸氢钾),![]() 溶液呈酸性,用化学平衡原理解释:__________________。
溶液呈酸性,用化学平衡原理解释:__________________。
②在一定的![]() 溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
溶液中滴加NaOH溶液至中性。下列关系一定不正确的是_______(填字母)。
A.![]()
B.![]()
C.![]()
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的_____填“正”或“负”)极,负极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图:
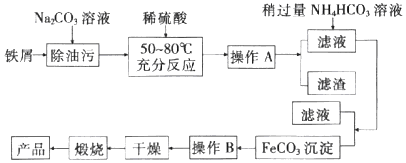
回答下列问题:
![]() 操作A、B的名称分别是______、______;加入稍过量的
操作A、B的名称分别是______、______;加入稍过量的![]() 溶液的作用是______。
溶液的作用是______。
![]() 写出在空气中充分加热煅烧
写出在空气中充分加热煅烧![]() 的化学方程式:______。
的化学方程式:______。
![]() 上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中
上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中![]() 的含量,进行如下实验:
的含量,进行如下实验:
![]() 称取样品
称取样品![]() ,加入足量稀
,加入足量稀![]() 溶解,并加水稀释至100mL;
溶解,并加水稀释至100mL;
![]() 量取
量取![]() 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;
![]() 用酸化的
用酸化的![]() 标准液滴定至终点;
标准液滴定至终点;
![]() 重复操作b、
重复操作b、![]() 次,得出消耗
次,得出消耗![]() 溶液体积的平均值为
溶液体积的平均值为![]() 。
。
![]() 写出滴定过程中发生反应的离子方程式:______。
写出滴定过程中发生反应的离子方程式:______。
![]() 确定滴定达到终点的操作及现象为______。
确定滴定达到终点的操作及现象为______。
![]() 上述样品的质量分数为______。
上述样品的质量分数为______。
![]() 下列操作会导致样品中
下列操作会导致样品中![]() 的质量分数测定结果偏低的有______。
的质量分数测定结果偏低的有______。
![]() 未干燥锥形瓶
未干燥锥形瓶 ![]() 盛装标准液的滴定管没有用标准液润洗
盛装标准液的滴定管没有用标准液润洗
![]() 滴定结束时仰视刻度线读数
滴定结束时仰视刻度线读数![]() 量取待测液的滴定管没有润洗
量取待测液的滴定管没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+202(g)=CO2(g)+2H2O(g) H=-890.3kJmol-1
B.500°C、30MPa下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为![]()
C.已知在120°C.101 kPa下,1 gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为![]()
D.25°C、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJmol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定大量共存的是( )
A. 含有AlO2-的溶液中:Na+ 、Al3+、Cl-、K+
B. 常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH![]() 、Cl-
、Cl-
C. 常温下 c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
D. 在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com