
| A. | pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 | |
| B. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] | |
| C. | pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 | |
| D. | 0.10 mol•L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
分析 A.氨水为弱碱,混合液中氨水过量,溶液呈碱性;
B.氯气溶于水,只有部分氯气与水反应,则氯水中仍然存在大量的氯气分子;
C.氨水为弱碱,稀释后期电离程度增大,则稀释后氨水中氢氧根离子浓度大于氢氧化钠;
D.根据碳酸钠溶液中的电荷守恒判断.
解答 解:A.pH=4的盐酸与pH=10的氨水溶液等体积混合后,氨水为弱碱,则混合液中氨水过量,混合液呈碱性,溶液的pH>7,故A正确;
B.氯水中存在未参与反应的氯气,则c(Cl2)≠2[c(ClO-)+c(Cl-)+c(HClO)],故B错误;
C.pH=11的NaOH和pH=11的氨水分别稀释100倍,由于氨水的电离程度增大,则稀释后氨水中氢氧根离子浓度较大,所以pH前者一定小于后者,故C错误;
D.0.10mol•L-1Na2CO3溶液中,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较、溶液pH的计算,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,注意掌握电荷守恒的含义及应用方法,B为易错点,注意氯水中还存在大量氯气.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 2011国际化学年,为纪念瑞士化学家Reichstein 1933年首先合成维生素C,瑞士发行了一枚印有Vc分子(C6H8O6)的3D效果邮票(如右图,图中小短棍可表示单键、双键或叁键).下列关于Vc说法正确的是( )
2011国际化学年,为纪念瑞士化学家Reichstein 1933年首先合成维生素C,瑞士发行了一枚印有Vc分子(C6H8O6)的3D效果邮票(如右图,图中小短棍可表示单键、双键或叁键).下列关于Vc说法正确的是( )| A. | 维生素C结构中包含了一个五元碳环 | |
| B. | 从结构来看,维生素C不溶于水 | |
| C. | 维生素C具有羟基和酯基两种官能团 | |
| D. | 维生素C能与氢气、溴水、氢氧化钠溶液等发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温度,同体积的N2和O2 | B. | 同质量,不同密度的N2和CO | ||
| C. | 同压强,同体积的H2和CH4? | D. | 同体积,同密度的CO2和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+、SO42-、CH3COO- | B. | HCO3-、K+、Cl-、AlO2- | ||
| C. | Cu2+、Na+、SO42-、HS- | D. | Na+、H+、SO42-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将滴有稀硫酸的淀粉溶液加热后,加入新制的Cu(OH)2悬浊液,加热,没有红色沉淀,说明淀粉在该条件下没有水解 | |
| B. | 将铜与足量的浓硝酸反应生成的气体干燥后收集,用冰水混合物冷却降温,研究温度对化学平衡的影响 | |
| C. | 将混合气体通过饱和Na2CO3溶液以便除去CO2中少量的SO2 | |
| D. | 某无色溶液中加入Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁醛 CH3CH2 (CH3)CHCOH | B. | 硬酯酸甘油脂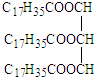 | ||
| C. | TNT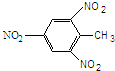 | D. | α-氨基丙酸 CH3CH(NH2)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液显中性 | |
| B. | 该溶液中:2 c(Al3+)+c(Fe2+)+c(H+ )=4 c(SO42-)+c(OH-) | |
| C. | 在空气中蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 | |
| D. | 向该溶液中加入Ba(OH)2溶液,当SO42-完全沉淀时,Al3+、Fe2+恰好被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
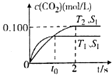 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:| 容器编号 | 起始物质的量 | 平衡时物质的量 |
| Ⅰ | 2.0mol NO,2.0mol CO | 1.0mol CO2 |
| Ⅱ | 4.0mol NO,4.0mol CO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com