
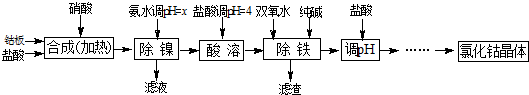
| 化学式 | 沉淀完全时的pH | 钴镍性质 |
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH4+ Co2++2H2O?Co(OH)2+2H+ Ni+2HCl=NiCl2+H2↑ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 9.6 | |
| Fe(OH)3 | 3.7 |
| 加NH3?H2O调pH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
| 10-14 |
| c(OH-) |
| c(H+)3 |
| c(Fe3+) |
| 10-42 |
| c(Fe3+)?c(OH-)3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、足量Fe在1 mol Cl2中充分燃烧,转移2NA个电子 |
| B、7.8 g Na2O2中阴、阳离子总数为0.4NA |
| C、电解精炼铜时,若转移NA个电子,则阳极减少的质量为32g |
| D、反应KClO3+6HClKCl+3Cl2↑+3H2O中,若有1 mol Cl2生成,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
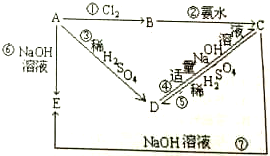 已知A为金属单质,根据如图物质的变化,回答:
已知A为金属单质,根据如图物质的变化,回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com