
| A. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ |
分析 A.电子、电荷不守恒;
B.反应生成氢氧化铝和碳酸氢钠;
C.醋酸在离子反应中保留化学式;
D.反应生成硝酸和NO.
解答 解:A.FeCl3溶液与Cu的反应的离子反应为Cu+2Fe3+═Cu2++2Fe2+,故A错误;
B.向NaAlO2溶液中通入过量CO2的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故B错误;
C.醋酸溶液与水垢中的CaCO3反应的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D.NO2与水的反应的离子反应为3NO2+H2O═2NO3-+NO+2H+,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O7 2->Fe3+ | |
| C. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 | |
| D. | CrO42- 和Fe2+在酸性溶液中可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+4H2O(g)═Fe3O4+4H2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2? | D. | Cl2+2H2O═HClO+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L的 Na2S溶液中S2-的个数为0.1NA | |
| B. | 标准状况下,11.2LH2所含的中子数为0.15 NA | |
| C. | 7.8g Na2O2与足量的水反应,转移的电子数为0.2 NA | |
| D. | 1mol羟基所含电子数为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释或解决方法 |
| A | 大量的燃煤、燃油是形成雾霾的主要原因, | 发展核能等清洁能源,减少化石燃料的使用 |
| B | “地沟油”是被氧化、分解的油脂,禁止食用 | 采用化学技术处理后代替汽油作燃料 |
| C | 氢氧化钠与氢氟酸都能与硅、二氧化硅反应 | 硅、二氧化硅都具有两性 |
| D | 漂白粉在空气中久置变质是 | 漂白粉中的有效成分与空气中的CO2反应生成CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
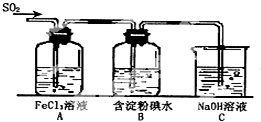 某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 0.50mol/L H2SO4溶液与50mL 0.50mol/L Ba(OH)2溶液 | |
| B. | 50mL 0.50mol/L盐酸溶液与50mL 0.50mol/L NaOH溶液 | |
| C. | 50mL 0.50mol/LCH3COOH溶液与50mL 0.50mol/L NaOH溶液 | |
| D. | 50mL 0.50mol/L盐酸溶液与50mL 0.50mol/L氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com